Марганец (original) (raw)
| Марганец | |
|---|---|
| ← Хром | Железо → | |
25 Mn↓Tc  Периодическая система элементов25Mn Периодическая система элементов25Mn  |
|
| Внешний вид простого вещества | |
 Электролитический марганец Электролитический марганец |
|
| Свойства атома | |
| Название, символ, номер | Марганец / Manganum (Mn), 25 |
| Группа, период, блок | 7 (устар. 7), 4, d-элемент |
| Атомная масса (молярная масса) | 54,938045 (5)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d54s2 1s22s22p63s23p63d54s2 |
| Радиус атома | 127 пм |
| Химические свойства | |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+7e) 46 (+2e) 80 пм |
| Электроотрицательность | 1,55 (шкала Полинга) |
| Электродный потенциал | −1,180 В |
| Степени окисления | 0; +1; +2; +3; +4; +5; +6; +7 |
| Энергия ионизации (первый электрон) | 716,8 (7,43) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 7,21 г/см³ |
| Температура плавления | 1 517 К (1243 °C) |
| Температура кипения | 2 235 К (1961 °C) |
| Мол. теплота плавления | 13,4 кДж/моль |
| Мол. теплота испарения | 221 кДж/моль |
| Молярная теплоёмкость | 26,3[2] Дж/(K·моль) |
| Молярный объём | 7,35 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | Кубическая |
| Параметры решётки | 8,890 Å |
| Температура Дебая | 400 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 6,87[3] Вт/(м·К) |
| Номер CAS | 7439-96-5 |
Ма́рганец (химический символ — Mn, от лат. Manganum) — химический элемент 7-й группы (по устаревшей классификации — побочной подгруппы седьмой группы, VIIB) четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25.
Простое вещество марганец — это твёрдый, но одновременно с этим, хрупкий переходный металл серебристо-белого цвета. Относится к цветным металлам.
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом чёрной магнезии, к которому магнит «равнодушен». В 1774 году шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (рус. марганец происходит от нем. Manganerz — магнезийная руда).
Марганец — 15-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл[_источник не указан 96 дней_], содержащийся в земной коре (0,085 % массы земной коры)[4]. Массовая доля марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7—10−6 %), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·_x_H2O) и опускается в нижние слои океана, формируя так называемые железомарганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности[_источник не указан 96 дней_].
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле[5][6][7]. Большие запасы марганца обнаружены в Томторском месторождении в Якутии[8].
- пиролюзит MnO2·_x_H2O, самый распространённый минерал (содержит 63,2 % марганца);
- манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
- браунит 3Mn2O3·MnSiO3 (69,5 % марганца);
- гаусманит (MnIIMn2III)O4;
- родохрозит (марганцевый шпат, малиновый шпат) MnCO3 (47,8 % марганца);
- псиломелан _m_MnO·MnO2·_n_H2O (45-60 % марганца);
- пурпурит Mn3+[PO4], (36,65 % марганца).
Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой[2].
Некоторые свойства приведены в таблице. Другие свойства марганца:
- Работа выхода электрона: 4,1 эВ
- Коэффициент теплового расширения: 0,000022 K−1 (при 0 °C)
- Электропроводность: 0,00695⋅106 Ом−1·см−1
- Теплопроводность: 0,0782 Вт/(см·K)
- Энтальпия атомизации: 280,3 кДж/моль при 25 °C
- Энтальпия плавления: 14,64 кДж/моль
- Энтальпия испарения: 219,7 кДж/моль
- Твёрдость:
- по шкале Бринелля: 196 МПа
- по шкале Мооса: 4[9]
- Давление паров: 121 Па при 1244 °C
- Молярный объём: 7,35 см3/моль
Стандартный окислительно-восстановительные потенциалы по отношению к водородному электроду
| Окисленная форма | Восстановленная форма | Среда | _E_0, В |
|---|---|---|---|
| Mn2+ | Mn | H+ | −1,186 |
| Mn3+ | Mn2+ | H+ | +1,51 |
| MnO2 | Mn3+ | H+ | +0,95 |
| MnO2 | Mn2+ | H+ | +1,23 |
| MnO2 | Mn(OH)2 | OH− | −0,05 |
| MnO42− | MnO2 | H+ | +2,26 |
| MnO42− | MnO2 | OH− | +0,62 |
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ | H+ | +1,51 |
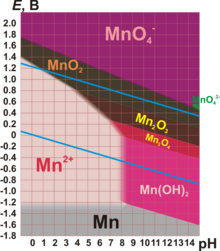
Диаграмма Пурбе для марганца
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны, а степень окисления −1 встречается очень редко).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
Mn + O 2 ⟶ MnO 2 {\displaystyle {\ce {Mn + O2 -> MnO2}}}
Марганец при реакции с перегретым водяным паром, образует гидроксид, вытесняя водород:
Mn + 2 H 2 O → ∘ t Mn ( OH ) 2 + H 2 ↑ {\displaystyle {\ce {Mn{}+2H2O->[^{\circ }t]Mn(OH)2{}+H2\uparrow }}}
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
С соляной и серной кислотами реагирует по уравнению
Mn + 2 H + ⟶ Mn 2 + + H 2 ↑ {\displaystyle {\ce {Mn{}+2H^{+}->Mn^{2}+{}+H2\uparrow }}}
С концентрированной серной кислотой реакция идёт по уравнению
Mn + 2 H 2 SO 4 ⟶ MnSO 4 + SO 2 ↑ + 2 H 2 O {\displaystyle {\ce {Mn{}+2H2SO4->MnSO4{}+SO2\uparrow +2H2O}}}
С разбавленной азотной кислотой реакция идёт по уравнению
3 Mn + 8 HNO 3 ⟶ 3 Mn ( NO 3 ) 2 + 2 NO ↑ + 4 H 2 O {\displaystyle {\ce {3Mn{}+8HNO3->3Mn(NO3)2{}+2NO\uparrow +4H2O}}}
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях — жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·Mn2O3, или соль Mn2MnO4).
При сплавлении оксида марганца(IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
2 MnO 2 + 4 KOH + O 2 ⟶ 2 K 2 MnO 4 + 2 H 2 O {\displaystyle {\ce {2 MnO2{}+ 4 KOH{}+ O2 -> 2 K2MnO4{}+ 2 H2O}}}
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция
3 K 2 MnO 4 + 3 H 2 SO 4 ⟶ 3 K 2 SO 4 + 2 HMnO 4 + MnO ( OH ) 2 ↓ + H 2 O {\displaystyle {\ce {3 K2MnO4{}+ 3 H2SO4 -> 3 K2SO4{}+ 2 HMnO4{}+ MnO(OH)2 v + H2O}}}
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4−, и из него выпадает коричневый осадок оксида-гидроксида марганца(IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия)
2 KMnO 4 → ∘ t K 2 MnO 4 + MnO 2 + O 2 {\displaystyle {\ce {2KMnO4->[^{\circ }t]K2MnO4{}+MnO2{}+O2}}}
Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:
2 MnSO 4 + 5 PbO 2 + 6 HNO 3 ⟶ 2 HMnO 4 + 2 PbSO 4 + 3 Pb ( NO 3 ) 2 + 2 H 2 O {\displaystyle {\ce {2 MnSO4{}+ 5 PbO2{}+ 6 HNO3 -> 2 HMnO4{}+ 2 PbSO4{}+ 3 Pb(NO3)2{}+ 2 H2O}}}
Эта реакция используется для качественного определения Mn2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn(II) из них выпадает осадок гидроксида марганца(II), быстро буреющий на воздухе в результате окисления. Подробное описание реакции см. в разделе «Определение методами химического анализа». В нейтральных или кислых водных растворах ион Mn2+ образует окрашенный в бледно-розовый цвет аквакомплекс [Mn(H2O)6]2+.
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основный характер, MnO(OH)2 — амфотерный. Хлорид марганца(IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:
MnO 2 + 4 HCl ⟶ MnCl 2 + Cl 2 ↑ + 2 H 2 O {\displaystyle {\ce {MnO2{}+4HCl->MnCl2{}+Cl2\uparrow +2H2O}}}
Нулевая степень окисления у марганца проявляется в соединениях с σ-донорными и π-акцепторными лигандами. Так, для марганца и известен карбонил состава Mn2(CO)10.
Известны и другие соединения марганца с σ-донорными и π-акцепторными лигандами (PF3, NO, N2, P(C5H5)3).
2 Na + Mn 2 ( CO ) 10 ⟶ 2 Na [ Mn ( CO ) 5 ] {\displaystyle {\ce {2 Na + Mn2{}(CO)10{}-> 2 Na[Mn(CO)5{}]}}}
Марганец является моноизотопным элементом — в природе существует только один устойчивый изотоп 55Mn. Все другие изотопы марганца нестабильны и радиоактивны, они получены искусственно. Известны 25 радиоактивных изотопов марганца, имеющие массовое число А в диапазоне от 44 до 70. Наиболее стабильными из них являются 53Mn (период полураспада _T_1/2 = 3,7 млн лет), 54Mn (_T_1/2 = 312,3 суток) и 52Mn (_T_1/2 = 5,591 суток). Преобладающим каналом распада лёгких изотопов марганца (А < 55) является электронный захват (и иногда конкурирующий с ним позитронный распад) в соответствующие изотопы хрома. У тяжёлых изотопов (А > 55) основным каналом распада является β−-распад в соответствующие изотопы железа. Известны также 7 изомеров (метастабильных возбуждённых состояний) с периодами полураспада более 100 нс.
Марганец в виде ферромарганца применяется для раскисления стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12—13 % Mn в сталь (так называемая сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твёрдой и сопротивляющейся износу и ударам (т. н. «наклёп»). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn, применяемый при выплавке стали.
В 1920—1940-х годах применение марганца позволяло выплавлять броневую сталь. В начале 1950-х годов в журнале «Сталь» возникла дискуссия по вопросу о возможности снижения содержания марганца в чугуне, и тем самым отказа от поддержки определённого содержания марганца в процессе мартеновской плавки, в которой, вместе с В. И. Явойским и В. И. Баптизманским, принял участие Е. И. Зарвин, который на основе производственных экспериментов показал нецелесообразность существовавшей технологии. Позже он показал возможность ведения мартеновского процесса на маломарганцовистом чугуне. С пуском ЗСМК началась разработка передела низкомарганцовистых чугунов в конвертерах[10].
Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр.
Марганец вводят в бронзы и латуни.
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO2 используется в таких элементах в качестве окислителя-деполяризатора.
Соединения марганца также широко используются как в тонком органическом синтезе (MnO2 и KMnO4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением _p_-ксилола, окисление парафинов в высшие жирные кислоты).
Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением.
Теллурид марганца — перспективный термоэлектрический материал (термо-ЭДС 500 мкВ/К).
Марганец принадлежит к пятой аналитической группе катионов.
Специфические реакции, используемые в аналитической химии для обнаружения катионов Mn2+, следующие:
1. Едкие щёлочи с солями марганца(II) дают белый осадок гидроксида марганца(II):
M n S O 4 + 2 K O H → M n ( O H ) 2 ↓ + K 2 S O 4 {\displaystyle {\mathsf {MnSO_{4}+2KOH\rightarrow Mn(OH)_{2}\downarrow +K_{2}SO_{4}}}}
M n 2 + + 2 O H − → M n ( O H ) 2 ↓ {\displaystyle {\mathsf {Mn^{2+}+2OH^{-}\rightarrow Mn(OH)_{2}\downarrow }}}
Осадок на воздухе меняет цвет на бурый из-за окисления кислородом воздуха.
Выполнение реакции. К двум каплям раствора соли марганца добавляют две капли раствора щёлочи. Наблюдают изменение цвета осадка.
2. Пероксид водорода в присутствии щёлочи окисляет соли марганца(II) до тёмно-бурого соединения марганца(IV):
M n S O 4 + H 2 O 2 + 2 N a O H → M n O ( O H ) 2 ↓ + N a 2 S O 4 + H 2 O {\displaystyle {\mathsf {MnSO_{4}+H_{2}O_{2}+2NaOH\rightarrow MnO(OH)_{2}\downarrow +Na_{2}SO_{4}+H_{2}O}}}
M n 2 + + H 2 O 2 + 2 O H − → M n O ( O H ) 2 ↓ + H 2 O {\displaystyle {\mathsf {Mn^{2+}+H_{2}O_{2}+2OH^{-}\rightarrow MnO(OH)_{2}\downarrow +H_{2}O}}}
Выполнение реакции. К двум каплям раствора соли марганца добавляют четыре капли раствора щёлочи и две капли раствора H2O2.
3. Диоксид свинца PbO2 в присутствии концентрированной азотной кислоты при нагревании окисляет Mn2+ до MnO4− с образованием марганцевой кислоты малинового цвета:
2 M n S O 4 + 5 P b O 2 + 6 H N O 3 → 2 H M n O 4 + 2 P b S O 4 ↓ + 3 P b ( N O 3 ) 2 + 2 H 2 O {\displaystyle {\mathsf {2MnSO_{4}+5PbO_{2}+6HNO_{3}\rightarrow 2HMnO_{4}+2PbSO_{4}\downarrow +3Pb(NO_{3})_{2}+2H_{2}O}}}
2 M n 2 + + 5 P b O 2 + 4 H + → 2 M n O 4 − + 5 P b 2 + + 2 H 2 O {\displaystyle {\mathsf {2Mn^{2+}+5PbO_{2}+4H^{+}\rightarrow 2MnO_{4}^{-}+5Pb^{2+}+2H_{2}O}}}
Эта реакция даёт отрицательный результат в присутствии восстановителей, например хлороводородной кислоты и её солей, так как они взаимодействуют с диоксидом свинца, а также с образовавшейся марганцевой кислотой. При больших количествах марганца провести эту реакцию не удаётся, так как избыток ионов Mn2+ восстанавливает образующуюся марганцевую кислоту HMnO4 до MnO(OH)2, и вместо малиновой окраски появляется бурый осадок. Вместо диоксида свинца для окисления Mn2+ в MnO4− могут быть использованы другие окислители, например, персульфат аммония (NH4)2S2O8 в присутствии катализатора — ионов Ag+ или висмутат натрия NaBiO3:
2 M n S O 4 + 5 N a B i O 3 + 16 H N O 3 → 2 H M n O 4 + 5 B i ( N O 3 ) 3 + N a N O 3 + 2 N a 2 S O 4 + 7 H 2 O {\displaystyle {\mathsf {2MnSO_{4}+5NaBiO_{3}+16HNO_{3}\rightarrow 2HMnO_{4}+5Bi(NO_{3})_{3}+NaNO_{3}+2Na_{2}SO_{4}+7H_{2}O}}}
Выполнение реакции. В пробирку вносят стеклянным шпателем немного PbO2, а затем 5 капель концентрированной азотной кислоты HNO3 и нагревают смесь на кипящей водяной бане. В нагретую смесь добавляют 1 каплю раствора сульфата марганца(II) MnSO4 и снова нагревают 10—15 мин, встряхивая время от времени содержимое пробирки. Дают избытку диоксида свинца осесть и наблюдают малиновую окраску образовавшейся марганцевой кислоты.
При окислении висмутатом натрия реакцию проводят следующим образом. В пробирку помещают 1—2 капли раствора сульфата марганца(II) и 4 капли 6 н. HNO3, добавляют несколько крупинок висмутата натрия и встряхивают. Наблюдают появление малиновой окраски раствора.
4. Сульфид аммония (NH4)2S осаждает из раствора солей марганца сульфид марганца(II), окрашенный в телесный цвет:
M n S O 4 + ( N H 4 ) 2 S → M n S ↓ + ( N H 4 ) 2 S O 4 {\displaystyle {\mathsf {MnSO_{4}+(NH_{4})_{2}S\rightarrow MnS\downarrow +(NH_{4})_{2}SO_{4}}}}
M n 2 + + S 2 − → M n S ↓ {\displaystyle {\mathsf {Mn^{2+}+S^{2-}\rightarrow MnS\downarrow }}}
Осадок легко растворяется в разбавленных минеральных кислотах и даже в уксусной кислоте.
Выполнение реакции. В пробирку помещают 2 капли раствора соли марганца(II) и добавляют 2 капли раствора сульфида аммония.
Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом. Марганец оказывает влияние на рост, образование крови и функции половых желёз. Особо богаты марганцем листья свёклы и плоды дуриана — до 0,03 %, а также большие его количества содержатся в организмах рыжих муравьёв — до 0,05 %. Некоторые бактерии содержат до нескольких процентов марганца.
Избыточное накопление марганца в организме сказывается, в первую очередь, на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти. Марганец является политропным ядом, поражающим также лёгкие, сердечно-сосудистую и гепатобиллиарную системы, вызывает аллергический и мутагенный эффект.
Токсическая доза для человека составляет 40 мг марганца в день. Летальная доза для человека не определена.
При пероральном поступлении марганец относится к наименее ядовитым микроэлементам. Главными признаками отравления марганцем у животных являются угнетение роста, понижение аппетита, нарушение метаболизма железа и изменение функции мозга.
Сообщений о случаях отравления марганцем у людей, вызванных приёмом пищи с высоким содержанием марганца, нет[_нет в источнике_]. В основном отравление людей наблюдается в случаях хронической ингаляции больших количеств марганца на производстве[11]. Оно проявляется в виде тяжёлых нарушений психики, включая гиперраздражительность, гипермоторику и галлюцинации — «марганцевое безумие». В дальнейшем развиваются изменения в экстрапирамидной системе, подобные болезни Паркинсона.
Чтобы развилась клиническая картина хронического отравления марганцем, обычно требуется несколько лет. Она характеризуется достаточно медленным нарастанием патологических изменений в организме, вызываемых повышенным содержанием марганца в окружающей среде (в частности, распространение эндемического зоба, не связанного с дефицитом иода).
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 647. — 671 с. — 100 000 экз. В. В. Еремин и др. Химия. 10 класс. Профильный уровень. — Москва: Дрофа, 2008. — С. 166. — 463 с. — 7000 экз. — ISBN 978-5-358-01584-5.
- ↑ В. Е. Зиновьев. Теплофизические свойства металлов при высоких температурах. — 1989. — 384 с. Архивировано 21 ноября 2013 года.
- ↑ Е. Г. Хайкина. Нахождение в природе, получение и применение простых веществ // Неорганическая химия. Химия марганца, технеция, рения: учебное пособие (рус.). — Улан-Удэ: БНЦ СО РАН, 2020. — С. 11. — 78 с. — 100 экз. — ISBN 978-5-7925-0596-4. — doi:10.31554/978-5-7925-0596-4-2020-3-76.
- ↑ Марганцевая независимость: задача с тремя неизвестными (рус.). MetallPlace.ru (15 мая 2023). Дата обращения: 12 августа 2024.
- ↑ Марганцевые руды России. 2017 год. Государственный доклад «О состоянии и использовании минерально-сырьевых ресурсов Российской Федерации в 2016 и 2017 годах» (рус.). Недра ДВ (2017). Дата обращения: 12 августа 2024.
- ↑ Боярко Г. Ю., Хатьков В. Ю. Критические товарные потоки марганцевого сырья в России (рус.) // Известия Томского политехнического университета. Инжиниринг георесурсов. — Томск: ТПУ, 2020. — Т. 331, № 4. — С. 38–53. — ISSN 2413-1830. — doi:10.18799/24131830/2020/4/2592. Архивировано 12 августа 2024 года.
- ↑ Сергей Набивачев. Ученые нашли крупное месторождение марганца в Якутии (рус.). Российская газета (17 мая 2024). Дата обращения: 8 июня 2024. Архивировано 8 июня 2024 года.
- ↑ Поваренных А. С. Твёрдость минералов. — АН УССР, 1963. — С. 197—208. — 304 с.
- ↑ Охотский В. Б. Металлургия России на рубеже XXI века. Новокузнецк. 2005.
- ↑ Лопина О. Д.; Аврунина Г. А. (рад.), Воронцова E. И., Прядилова H. В. (гиг.), Рыжкова М. Н. (клиника), Хижнякова К. И. (суд.). Марганец // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1980. — Т. 13 : Ленин и здравоохранение — Мединал. — С. 417—420. — 552 с. : ил.
- Марганец : [арх. 3 января 2023] / Зимина Г. В. // Большая российская энциклопедия [Электронный ресурс]. — 2017.
- Марганец // Популярная библиотека химических элементов / Сост. В. В. Станцо, М. Б. Черненко. — М.: Наука, 1983. — Кн. 1. Водород - палладий. — 575 с.
- Прокин В. А. 4.3. Марганцевые руды // Месторождения полезных ископаемых Урала / Отв. ред. В. А. Коротеев, В. А. Прокин. — Екатеринбург: Ин-т геологии и геохимии УрО РАН, 1999. — 183 с. — ISBN 5-7691-0936-X.
- Марганец на Webelements

![{\displaystyle {\ce {Mn{}+2H2O->[^{\circ }t]Mn(OH)2{}+H2\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/12d72ac7a850fbf2fb0a137b2000ceaaff482a61)





![{\displaystyle {\ce {2KMnO4->[^{\circ }t]K2MnO4{}+MnO2{}+O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b6b513a4b27d4fcd10197c138653ec9021c55980)


![{\displaystyle {\ce {2 Na + Mn2{}(CO)10{}-> 2 Na[Mn(CO)5{}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/99c1eed8a87d9cfa0c2b98d15b5aadd576ab15f1)








