Микроорганизмы, токсины и эпидемии. 2.2. Как возникают «новые» инфекционные болезни? (original) (raw)
«Новыми» называются инфекционные болезни, недавно возникшие в популяциях людей либо существовавшие там ранее, но количество их случаев начало вдруг быстро расти, либо они распространились в новом для них географическом регионе (табл. 15).
Таблица 15
Примеры недавно появившихся инфекций
| Инфекция или агент | Факторы, необходимые для их возникновения |
|---|---|
| Вирусные | |
| Аргентинская и боливийская геморрагические лихорадки | Изменения в сельском хозяйстве, способствующие увеличению численности грызунов |
| Бычья спонгиформная энцефалопатия | Изменения в питании животных |
| Лихорадка Денге | Занос, миграция, урбанизация |
| Лихорадки Эбола и Марбург | Неизвестны, в Европу и США были занесены с обезьянами |
| Хантавирусы | Изменения в окружающей среде, увеличивающие контакты людей с природными резервуарами возбудителя (популяции грызунов) |
| Гепатиты В и С | Переливание крови, трансплантация органов, половое инфицирование, инъекции, вертикальное распространение от инфицированных матерей к детям |
| ВИЧ | Миграция в города и туризм, сексуальные контакты, вертикальная передача от инфицированных матерей к детям, контаминация через медицинские инструменты (включая внутривенное введение лекарств), переливание крови, трансплантация органов |
| HTLV | Контаминированные медицинские инструменты, другое |
| Пандемический грипп | Возможно, сельскохозяйственное разведение уток и свиней, что облегчает пересортировку генов птичьих вирусов и вирусов млекопитающих |
| Лихорадка Ласса | Урбанизация, способствующая увеличению численности грызунов — природных резервуаров возбудителя; увеличение экспозиции людей (обычно в домах) |
| Лихорадка долины Рифт | Строительство дамб, развитие сельскохозяйственного производства, ирригация; возможно, изменения в патогенности и вирулентности вируса |
| Желтая лихорадка в «новых» регионах | Формирование благоприятных условий для москитов — переносчиков возбудителя заболевания |
| Бактериальные | |
| Бразильская пурпурная лихорадка (Haemophilus influenzae, биотип aegyptius) | Вероятно, появился новый штамм |
| Холера | Недавние эпидемии в Южной Америке вызваны возбудителем, вероятно, завезенным из Азии с грузом. Его распространению способствовало уменьшение хлорирования воды. Новый штамм возбудителя (тип 0139) был разнесен из Азии путешественниками (т.е. так же как в прошлом распространялась классическая холера) |
| Helicobacter pylori | Вероятно, уже давно широко распространен, но не был распознан (ассоциировался с другими гастроинтестинальными болезнями) |
| Гемолитический уремический синдром (Escherichia coli 0157:Н7) | Массовые пищевые технологии, способствующие контаминации мяса |
| Legionella (легионеллезные болезни) | Охлаждающие и водопроводные системы (микроорганизм растет в биопленках, которые формируются в емкостях со стоячей водой) |
| Боррелиоз Лайма (Borrelia burgdorferi) | Преобразования природной среды вокруг населенных пунктов, способствующие распространению клещей (носителей заболевания) и оленей (его вторичных резервуаров) |
| Стрептококки группы А (инвазивные, некротизирующие) | Неизвестны |
| Синдром токсического шока (Staphylococcus aureus) | Ультраабсорбирующие тампоны |
| Паразитические | |
| Cryptosporidium и другие, распространяемые с водой патогены | Загрязнение поверхностных вод, плохая очистка воды |
| Малярия (в «новых» регионах) | Путешествия и миграция |
| Schistosomiasis | Строительство дамб |
*По S. Morse (1995).
S. Morse (1995) считает, что возникновение новой инфекционной болезни происходит в два этапа:
агент интродуцируется в новую популяцию хозяина;
закрепляется в ней и распространяется дальше в популяции нового хозяина.
Факторы, обеспечивающие один или оба этих этапа, стимулируют возникновение новой инфекции. По мнению этого же исследователя, большинство таких инфекций как, впрочем, и антибиотико-резистентных штаммов известных бактериальных патогенов, обычно возникают в одном географическом регионе, а затем распространяется в другие.
Большинство появившихся за последние годы инфекционных болезней вызваны патогенами, уже существовавшими в окружающей человека среде. Они получили преимущества перед другими паразитическими видами в результате изменения природных условий и образования нового механизма проникновения в популяции новых хозяев (только в очень редких случаях может возникнуть новый вариант микроорганизма, вызывающий новую инфекцию — см. «Микробные адаптация и изменения»).
В табл. 16 обобщены основные факторы, ответственные за появление «новых» инфекционных болезней [Morse S., 1995]. Эта классификация, как и любая другая, произвольна, но, тем не менее, она отражает те основные процессы, которые находятся в основе возникновения новых инфекций у людей.
Таблица 16
Факторы, способствующие появлению «новых» инфекционных болезней у людей*
| Факторы | Примеры специфических факторов | Примеры болезней |
|---|---|---|
| Экологические и климатические изменения | Сельское хозяйство; дамбы; изменения водных экосистем; наводнения; засуха; голод | Шистозомиаз (дамбы), лихорадка долины Рифт (дамбы, ирригация), аргентинская геморрагическая лихорадка (сельское хозяйство), хантавирусный легочный синдром (Юго-Восточная часть США, с 1993 г.; аномалии климата) |
| Демография и поведение людей | Социальные факторы: рост численности популяций и миграция (перемещение из сельских районов в города); войны или гражданские конфликты; упадок городов; сексуальное поведение; внутривенное введение лекарств; использование высокоплотного обслуживания (общественное питание и др.) | Проникновение ВИЧ; распространение лихорадки Денге; распространение ВИЧ и других заболеваний, инфицирование возбудителями которых осуществляется половым путем |
| Международный туризм и коммерция | Перемещение по всему миру товаров и людей; воздушный туризм | Малярия «аэропортов»; распространение москитов; хантавирусы, ввоз холеры в Южную Америку; распространение штамма V. cholerae 0139 |
| Технология и индустрия | Глобализация продовольственного снабжения; изменения в приготовлении и упаковке продуктов питания; трансплантация органов и тканей; использование лекарств, вызывающих иммуносупрессию; широкое распространение антибиотиков | Гемолитический уремический синдром (контаминация E. coli мяса гамбургеров); бычья спондиформная энцефалопатия; трансфузионные гепатиты (В и С); оппортунистические инфекции у иммуносупрессированных пациентов; болезнь Creutzfeldt-Jakob у людей, вызванная введением контаминированного гормона роста |
| Микробная адаптация и изменения | Микробная эволюция в ответ на селективное давление окружающей среды | Антибиотико-резистентные бактерии, антигенный «дрейф» вируса гриппа |
| Разрушение общественного здравоохранения | Сокращение профилактических программ; неадекватные санитария и контроль за переносчиками | Возвращение туберкулеза в США; холера в лагерях беженцев; возвращение дифтерии в бывшем Советском Союзе |
*По S. Morse (1995)
Возвращение возбудителей «старых» инфекционных болезней может быть результатом ошибок, допущенных в мерах по охране здоровья людей; изменениями, произошедшими в поведении людей; изменениями в обработке пищи и в привычках питания; изменениями во взаимодействии людей с окружающей средой [Lederberg J. et al., 1992].
Конечно, большинство инфекционных болезней у людей возникают из-за комбинации этих факторов. Далее мы рассмотрим каждый из них в отношении тех инфекционных болезней, в распространении которых в человеческих популяциях один из этих факторов играет ведущую роль.
Экологические изменения. Экологические взаимодействия могут быть сложными, ряд факторов часто взаимодействуют вместе или в какой-то последовательности друг за другом. Но они являются наиболее частыми из идентифицированных факторов, способствующих появлению той или иной инфекционной болезни. Особенно часто их отмечают при сопровождающихся большим количеством летальных исходах вспышках ранее нераспознанных инфекций, происходящих из наземного резервуара. Экологические факторы обычно ускоряют появление инфекционной болезни путем создания контакта людей с естественным резервуаром или хозяином инфекции. Последний до наступления эпидемии, может быть неизвестен [Morse S., 1995].
Формирование нового наземного резервуара может осуществляться деятельностью человека в течение столетия и более. Причем современники не способны представить себе отдаленные экологические последствия своих действий. Для их потомков инфекционная болезнь, проникшая в человеческое общество, становится неожиданностью, и они ее называют «новой». Ниже мы приведем пример необычно растянутой во времени «петли обратной связи» для событий, приведших к распространению болезни Лайма в США.
Возникновение болезни Лайма. В начале 1800-х гг. восточные районы США оказались фактически голыми, когда для развития сельского хозяйства были расчищены огромные пространства земли. С уничтожением лесов значительно уменьшилась популяция оленей. Однако в середине 1800-х гг. сельское хозяйство США начало быстро смещаться на запад к Грейт-Плейз (Большие равнины) и фермы были заброшены, в результате этого процесса огромные территории востока США вскоре снова покрылись лесами. В отличие от сравнительно открытого первичного леса, этот новый лесной массив представлял собой мелколесье, и в нем отсутствовало достаточное количество хищников, чтобы регулировать популяции оленей. Олени начали размножаться. Позже в этих лесных и сельских местностях начали останавливаться и жить люди. Данная тенденция продолжается и в настоящее время. Создавшееся в результате соседство людей, мышей, оленей и клещей открыло путь для распространения спирохеты, вызывающей болезнь Лайма, которая передается через укус клещей Ixodes. В настоящее время болезнь Лайма является в США наиболее распространенной болезнью, распространяемой переносчиками [Lederberg J. et al., 1992]. Так нынешнее поколение американцев отвечает перед природой за грехи своих праппрадедов.
Сельскохозяйственное развитие является одним из наиболее общих подходов к изменению людьми среды своего обитания.
Возникновение корейской геморрагической лихорадки. Вирус Хан-таан, ставший причиной почти 100 тыс. ежегодных случаев корейской геморрагической лихорадки в Китае, существует в Азии в течение тысячелетий. Вирус вызывает естественную инфекцию у полевой мыши Apodemus agrarius. Грызун процветает на рисовых полях, люди контактируют с больными грызунами и инфицируются во время сборки риса, т.е. эта болезнь — неизбежное следствие сельскохозяйственного развития, меняющего среду обитания людей [Morse S., 1995].
Возникновение аргентинской геморрагической лихорадки. Возбудитель этой болезни исторически никак не связан с вирусом Хантаан. Переориентация полей в Южной Америке на выращивание маиса, одновременно стимулировала размножение грызуна, который был естественным хозяином этого вируса. Случаи инфицирования людей нарастали пропорционально площади, занимаемой под выращивание маиса [Johnson К., 1993].
Большим сюрпризом для эпидемиологов стало обнаружение доказательств сельскохозяйственного происхождения пандемий гриппа (подробнее см. «микробная адаптация»).
Важную роль в появлении «новых» и возвращении побежденных инфекций, играют переносчики. Как это не покажется необычным, но в конце XX столетия их роль в возникновении вспышек и эпидемий забытых инфекций, по сравнению с первой половиной столетия, значительно повысилась. И, видимо, для этого есть серьезные причины (рис. 40).
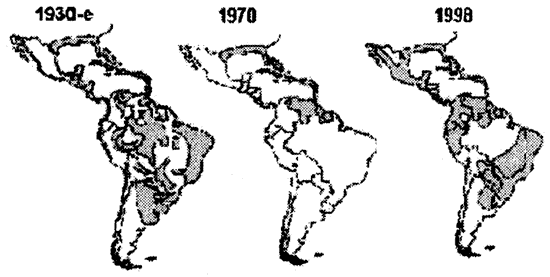
Рис. 40. Возвращение комара Aedes aegypti. Географическое распределение переносчика желтой лихорадки и лихорадки Дэнге — комара Aedes aegypti в Южной Америке в 1930-х гг., 1970-м и 1998-м гг. [Gubler D., 1998]. К сожалению, это опять пример необычно растянутой во времени «петли обратной связи». Уменьшение ареала переносчика обеих лихорадок в средине столетия, было связано не только с мерами, предпринятыми для борьбы с ним, но и с глобальным похолоданием 1940—1970 гг. (см. «Изменения климата»). Однако о похолодании стало известно только в конце 1980-х гг., уменьшение же популяций переносчиков современниками субъективно воспринималось как их «победа над врагом». «Возвращающиеся» москиты, как правило, резистентны к инсектицидам.
По мнению D. Gubler (1998) они следующие: резкое повышение устойчивости артроподов к действию инсектицидов; развитие лекарственной устойчивости у паразитов, переносимых артроподами; свертывание программ по борьбе с переносчиками; демографические и социальные изменения в окружающей среде.
Среди последних S. Morse (1995) выделяет водный фактор. Распространение москитов часто стимулирует расширение площадей водоемов со стоячей водой. Имеются многочисленные описания случаев переноса инфекционных болезней носителями, цикл размножения которых осуществляется с участием водной среды. Это вода у дамб, в системах ирригации, или хранящаяся питьевая вода для больших городов. Случаи японского энцефалита у людей исчисляются в Азии почти 30 тыс. заболевших ежегодно, из которых приблизительно 7 тыс. умирают. Количество случаев болезни находится в прямой зависимости от затапливаемых площадей для выращивания риса. Вспышки лихорадки долины Рифт в некоторых регионах Африки связаны со строительством дамб и периодами сильных ливней. Вспышка лихорадки долины Рифт, произошедшая в 1987 г. в Мавритании, имела место именно в деревнях, расположенных около дамб на реке Сенегал. Аналогичный эффект от мелиорации задокументирован и в отношении других инфекций, имеющих зависящих от воды хозяев, например, таких как шистосоматоз.
В табл. 17 приведены факторы внешней среды, способствующие повышению роли переносчиков в распространении возбудителей инфекционных болезней.
Таблица 17
Изменения внешней среды, приводящие к активизации переносчиков инфекционных болезней*
| Урбанизация | Уничтожение лесов | Сельскохозяйственная практика |
|---|---|---|
| Лихорадка Денге | Лоаоз | Малярия |
| Малярия | Онхоциркоз | Японский энцефалит |
| Желтая лихорадка | Малярия | Энцефалит Сан Луи |
| Чикунгунья | Лейшманиоз | Восточно-Нильская лихорадка |
| Эпидемические полиартриты | Желтая лихорадка | Оропуш |
| Восточно-Нильская лихорадка | Киасанурская лесная лихорадка | Восточный лошадиный энцефалит |
| Энцефалит Сан Луи | Энцефалит Ла Кросс | Венесуэльский энцефалит лошадей |
| Болезнь Лайма | Восточный лошадиный энцефалит | |
| Эрлихиоз | Энцефалит Сан Луи | |
| Чума | Болезнь Лайма |
По D. Gubler (1998).
Изменения климата. Мировой климат, хотя и чрезвычайно изменчивый в масштабах нескольких десятилетий, в целом, за последние 100 лет, стал теплее. Неуклонное повышение температуры было нарушено кратковременным похолоданием в 1940—1970-е гг., после которого потепление возобновилось, не обнаруживая уже никакого отступления. Все разработанные климатические модели предсказывают, что в ближайшие десятилетия потепление значительно усилиться [Джоунс Ф., Уигли Т., 1990]. Кроме того, крупные города представляют собой самостоятельные «острова тепла», населенные сотнями миллионов людей. Их укрупнение неизбежно вызовет рост случаев инфекций, возбудители которых распространяются переносчиками и водой, а также изменение границ регионов, в которых эти инфекции обычно имеют место (рис. 41).
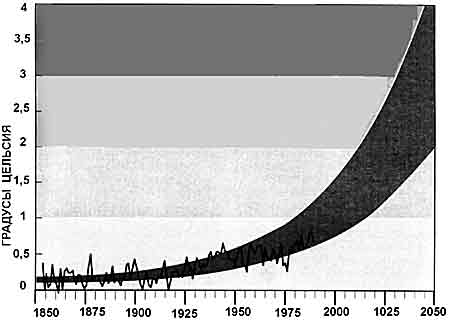
Рис. 41. Прогнозы глобального потепления. Диапазон величин глобального потепления, предсказываемый различными компьютерными моделями (выделена межпунктирными линиями), примерно соответствует тому, что дают архивные данные. Все модели говорят о том, что в ближайшие десятилетия потепление значительно усилится [Джоунс Ф.Д., Уигли Т.Л., 1990].
Перечень инфекционных болезней, на распространении которых скажется глобальное потепление, приведен в табл. 18.
Таблица 18
Инфекционные болезни, распространение которых будет увеличиваться при потеплении климата*
| Болезнь | Популяция риска, млн | Распространенность инфекции сегодня, млн | Географический регион | Возможность климатического воздействия |
|---|---|---|---|---|
| Малярия | 2100 | 270 | Тропики, субтропики | Очень возможно |
| Шистосомиаз | 600 | 200 | То же | То же |
| Африканский трипаносомоз | 50 | 25000 новых случаев за год | Тропическая Африка | Возможно |
| Лейшманиоз | 350 | 12 млн инфицированных + 400000 новых случаев за год | Азия, Южная Европа, Африка, Северная Америка | Неизвестно |
| Дранкулез | 63 | 1 | Тропики (Африка, Азия) | Невозможно |
| Арбовирусные инфекции, Денге | Тропики, субтропики | Очень возможно | ||
| Желтая лихорадка | Африка, Латинская Америка | Возможно | ||
| Японский энцефалит | Восточная и Юго-Восточная Азия | То же | ||
| Другие арбовирусные болезни | Тропические температурные зоны | То же | ||
| Холера | Глобальное распространение морскими течениями | Очень возможно |
* По J. Patz и соавт. (1996).
Разумеется, перечень далеко не полный. Ниже мы остановимся на особенностях климатического воздействия на отдельные инфекции.
Малярия. Возвращение малярии было замечено еще в 1973 г. Тогда же было обнаружено более 50 видов комаров, устойчивых к инсектицидам, используемым для борьбы с ними после 1947 г. Позже выяснилось, что во многих регионах, где малярия считалась почти уничтоженной, болезнь как бы очнулась и уровень заболеваемости превысил исходный [Gilles H., 1993]. Малярия обычно поддерживается в регионах, где зимняя температурная изотерма не опускается ниже 16°С. Температура и влажность являются важными факторами распространения паразита и управляют продолжительностью его внешнего инкубационного периода (ВИП), т.е. развитием спорогоний. Наиболее оптимальной для ВИП малярии является температура в диапазоне от 20–27°С. Ниже 16°С и выше 30°С спорогония прекращается [Шувалова Е.П., 1973]. Вспышка малярии, связанная с локальными климатическими изменениями, наблюдалась в Руанде в 1987 г. Тогда высокая температура и проливные дожди привели к экспоненциальному распространению малярии на горные популяции людей, ранее никогда с ней не сталкивавшихся [Loevinsohn M., 1994].
Лихорадка Денге. Комары-переносчики возбудителя лихорадки Денге и их личинки не могут существовать в холодной воде, поэтому болезнь распространена между 30° северной широты и 20° южной. Глобальное повышение температуры способно сместить ареал переносчиков и, соответственно, природный очаг возбудителя лихорадки Денге в более высокие широты. Кроме того, обнаружена прямая связь между температурой и количеством укусов комаров, а также скоростью их инфицирования. Например, ВИП для вируса Денге II типа составляет 12 сут. при температуре 30°С, и только 7 сут. при температуре 32°С [Watts D. et al., 1987]. Сокращение инкубационного периода на 5 суток увеличивает трехкратно трансмиссионную способность москита, т.е. для распространения лихорадки Денге при данной температуре даже не требуется увеличения количества переносчиков.
Хантавирусный пульмонарный синдром. Вспышка произошла в юго-восточных Соединенных Штатах в 1993 г. Вероятно, в этом регионе вирус длительно поддерживался в популяциях мышей. Необычно умеренная зима и влажная весна способствовали увеличению численности грызунов весной и летом. Тем самым были созданы условия для контакта людей с инфицированными грызунами, а затем и с вирусом. Те же причины могут быть ответственны за вспышки хантавирусной инфекции примерно в это же время в Европе [Rollin P. et al., 1993].
Арбовирусные энцефалиты. Арбовирусы разносятся комарами. Эпидемии арбовирусных энцефалитов обычно возникают южнее июньской изотермы 20°С, но во влажные годы они могут продвигаться на север [Shope R., 1980]. На Северо-Американском континенте вспышки среди людей энцефалита Сан-Луи совпадают с периодами, когда дневная температура превышает 30°С, как, например, это имело место в США (Калифорния) в 1984 г. Повышение температуры резко активизирует переносчиков арбовирусов (рис. 42).
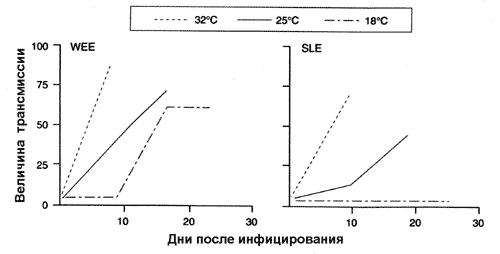
Рис. 42. Влияние температуры на скорость переноса комарами арбовирусов. Скорость трансмиссии выражается через процент укусов комаров Culex tarsalis, которые привели к передаче арбовируса. WEE — восточный энцефалит лошадей; SLE — энцефалит Сан Луи [Reeves et al., 1994].
Холера . За последнее столетие средняя температура морской поверхности возросла на 0,7°С, что привело к размножению фитопланктона и интенсивному цветению водорослей практически во всем мире. В близи крупных городов эта ситуация усугубляется большим количеством сбросов стоков, содержащих питательные вещества, стимулирующие рост водорослей [Patz J. et al., 1996]. Рассматривая в предыдущем разделе природный резервуар холерного вибриона, мы отметили то обстоятельство, что его высокую концентрацию могут поддерживать низшие ракообразные [Голубев Б. П., 1993] и зоопланктон [Islam M. et al., 1990]. Для зоопланктона водоросли являются пищей. Это способствует формированию множества прибрежных очагов холеры во всем мире и уже получены первые экспериментальные подтверждения того, что организмы, живущие в морской среде, являются естественными резервуарами холерного вибриона. Так A. Huq и соавт. (1990), используя флюоресцирующие антитела, обнаружили V.cholerae в оболочках и экзоскелетах морских организмов, которые им затем удалось перевести в культивируемое состояние при оптимальной рН, температуре и питательной среде [Epstein P. et al., 1993]. Следовательно, крупномасштабное воздействие потепления климата на океанические течения, способно привести к увеличению организмов-резервуаров V. cholerae и спровоцировать глобальную вспышку холеры (см. «Международный туризм и коммерция»).
Изменения человеческой демографии и поведение людей. Переме щения населения, вызванные войнами и катастрофами, часто являются важными факторами в возникновении инфекционных болезней. Сложившиеся во многих частях мира экономические условия, вынуждают рабочую силу перемещаться из сельских регионов в города. По оценкам ООН, в результате таких действий до 65% населения мира к 2000 г. будут жить в городах. Урбанизация позволяет инфекции, возникшей в изолированных сельских районах (которая могла бы остаться неизвестной и иметь ограниченное распространение), проникнуть в большие человеческие популяции городов. Попав в город, возбудитель одновременно приобретает возможность распространяться не только среди его населения, но и дальше, междугородным транспортом по шоссейным дорогам и самолетами [Morse S., 1995]. В качестве примера рассмотрим причины распространения вируса Денге в городах Юго-Восточной Азии.
Лихорадка Денге. Распространению вируса Денге в азиатских городах способствует быстрое увеличение числа открытых контейнеров на улицах и превышение численности населения над возможностями городской инфраструктуры. Как элемент городской среды, заполненная дождем тара и пустые пластиковые бутылки являются благоприятной средой для размножения москитов. «Москитный бум» дополняется высокой плотностью человеческой популяции. В этой ситуации увеличивается риск передачи возбудителя от больных людей здоровым [Morse S., 1995].
Вторжение в чужие экосистемы. Проникновение возбудителей новых инфекций в человеческую цивилизацию может быть вызвано вторжением людей в тропические леса. Среди них возбудители СПИДа, геморрагических лихорадок, оспы обезьян и др. Контакты с обитателями тропических лесов ведут к обмену патогенами по самым различным путям передачи. В обмен могут включаться переносчики-артроподы, вода, охотники за дикими животными. Например, габонская вспышка лихорадки Эбола в 1996 г., была связана с употреблением в пищу шимпанзе, которых местные охотники нашли мертвыми. Имели место случаи, когда во время лабораторных исследований случайно происходила экспозиция людей такими агентами как малярийные паразиты, вирус иммунодефицита обезьян и др. [Escalante A.A. et al., 1998].
Очень большую опасность представляет и обратный процесс — инфицирование от людей диких животных, особенно приматов. Тем самым среди близкородственных видов формируются вторичные природные очаги инфекций, которые среди людей считаются уничтоженными или контролируемыми (например, малярия, полиомиелит, туберкулез, проказа; табл. 19).
Таблица 19
Пути обмена патогенами между людьми и приматами
| Пути обмена | Патоген | Направление обмена |
|---|---|---|
| Укус животного | Герпес В, оспа обезьян | От обезьян к людям |
| Фекально-оральный | Полиовирус | От людей к обезьянам |
| То же | От шимпанзе к шимпанзе | |
| Охота, приготовление и поедание пищи | Вирус лихорадки Эбола | От обезьян к людям |
| Назальные секреты | Лепра | Между обезьянами |
| Воздушно-капельный | Туберкулез | От людей к обезьянам |
| Трансмиссивный | Малярия | Оба направления |
| Филярия | То же | |
| Водный | Дранкунлиаз | От людей к обезьянам |
| Шистосоматоз | От обезьян к людям | |
| Ксенотрансплантация | SV40 | От обезьян к людям |
* По А.А. Escalante и соавт. (1998)
Биологический терроризм и диверсии. Это уже давно существующая практика человеческих отношений. Кому первому пришло в голову мысль преднамеренно инфицировать возбудителями опасных болезней людей и скот, сказать трудно, но древние книги и хроники полны упоминаний об этом. Да и Господь не пренебрегает использованием биологических агентов в своих целях. Например, в Ветхом завете можно прочитать: «И наведу на вас мстительный меч... и пошлю на вас язву, и преданы будете в руки врага» (Левит, 26, стих 25) или «Посещу живущих на земле Египетской, как Я посетил Иерусалим, мечем, голодом и моровою язвою» (Иеремия, 44, стих 13). Особенности возникновения террористических вспышек и эпидемий инфекционных болезней, мы рассмотрим в специально посвященной этой проблеме подглаве 2.3.
Другие известные примеры влияния человеческого поведения на распространение инфекционных болезней — это половая активность и внутривенное введение наркотиков.
Международный туризм и коммерция. И в еще прошлом возбудители инфекций, ранее вызывавших болезни географически изолированных популяциях людей, могли быть перенесены путешественниками, торговцами или во время военных походов. Но в XX столетии миграция людей резко ускорилась. В последние годы возможности для переноса инфекций на большие расстояния стали значительно более разнообразными и многочисленными, что отражает увеличивающиеся объёмы, скорость и возможности перемещения по всему миру. Однако появление инфицированного человека в чужой для него стране, еще не означает укоренения там его болезни. Ниже мы приведем условия, показывающие, каким образом миграция приводит к появлению новых болезней в регионах (рис. 43).
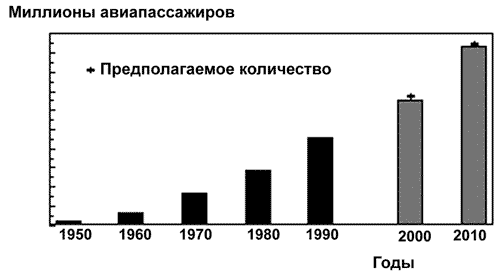
Рис. 43. Рост количества авиапассажиров в мире начиная с 1950-го года. Глобальные перевозки туристов, млн. в год [Altekruse S. et al., 1997].
Для того чтобы болезнь укоренилась в регионе посредством миграции, человек должен нести патоген, который может быть в принципе перенесен другим лицам (сразу или нет; прямо или косвенно). При этом сам возбудитель инфекционной болезни может ничем себя не проявлять (длительный инкубационный период болезни, хроническая или латентная форма инфекционного процесса). Например, вирус гепатита В, ВИЧ, возбудители туберкулеза, лепры, сальмонеллеза и др. Болезнь может приобрести особенно серьезный характер, если патоген проникает в популяцию, которой он ранее не был знаком. Завезенная в Новый Свет испанцами оспа вызвала гибель двух третей индейского населения. Необычайная по силе эпидемия «испанки» 1918 г., завезенная в США из Франции, дала исключительно высокую смертность только среди молодых людей и почти не затронула пожилое население, уже прошедшее «селективный отбор» прошлыми пандемиями гриппа, иначе и без того катастрофические последствия «испанки» были бы намного ужасней.
Критическими условиями распространения патогена в новой популяции являются продолжительность его существования в потенциально инфективной форме, а также способ и возможность его трансмиссии. Например, ВИЧ, гепатит В и малярия могут длительно передаваться с кровью. Но для первых двух инфекций это станет возможным, если здоровый человек использует иглу больного для внутривенного введения наркотика, передача же малярии станет возможной при наличии переносчика.
Кроме инфицированных людей, опасность завоза новых инфекций исходит от транспортных средств, импортируемых продуктов питания, препаратов на основе крови (см. «технологии и индустрия»), животных и растений. Животные могут переносить потенциальные человеческие патогены (возбудители чумы, оспы обезьян, лихорадки Марбург, лихорадки Эбола, туберкулеза, сибирской язвы, сапа и др.) и их переносчиков (клещи, блохи). Животные и артроподы могут путешествовать с людьми «зайцами» (грызуны, комары, клещи) и попав в новый регион, укореняться там вместе с принесенными ими патогенными микроорганизмами, либо включаться в поддержание циркуляции возбудителей инфекций уже имеющихся в регионе. В начале XVI столетия и в XVII столетии, суда, перевозившие рабов из Западной Африки в Новый Свет, перенесли на «новые земли» желтую лихорадку и ее переносчика — москита Aedes aegypti [Morse S., 1995].
Ниже мы приведем несколько примеров, иллюстрирующих многообразие существующих сегодня возможностей глобальной переброски возбудителей опасных инфекций.
Распространение инфекций кораблями. Перенос возбудителей инфекций и инфицированных ими организмов осуществляется поверхностями кораблей, балластной водой и с грузами. Например, 367 различных видов организмов было обнаружено в балластной воде судна, курсирующего между Японией и Орегоном (США) В отдельных регионах завоз чуждых организмов вызывает очень тяжелые последствия. Ввезенные в Черное и Азовское моря днищами судов медузоподробные организмы, называемые стенофорами, вызвали кризис местной рыбной отрасли [Travis J., 1993].
Предполагается, что завоз холерного вибриона в Южную Америку также был осуществлен судами. Исследователи обнаружили холерные вибрионы в пробах, взятых из балластной воды, днища и сточных вод 3 из 14 грузовых судов, стоявших в доках порта Мехико. Эти суда направлялись в Бразилию, Колумбию и Чили. V. cholerae 01, серотипа Inaba, биотипа El Tor, не отличающийся от латиноамериканского эпидемического штамма, был обнаружен в закрытых устрицах из Мобил Бея (Алабама, США) [De Paola A. et al., 19921.
Aedes albopictus (азиатский тигриный москит) был ввезен в США, Бразилию и некоторые регионы Африки в автомобильных покрышках из Азии [Craven R. et al., 1988]. В Азии он участвует в переносе возбудителя лихорадки Денге. Проникнув на территорию США в 1982 г., москит закрепился, по крайней мере, в 21 штате и активно включился в перенос местных вирусов, в том числе вируса, вызывающего восточный энцефалит лошадей [Morse S., 1995]. Москит агрессивен и способен выживать как в лесных, так и в городских ландшафтах. В лабораторных экспериментах было показано, что Aedes albopictus способен переносить вирус лихорадки Ла Кросс, вирус желтой лихорадки и ряд других опасных вирусов [Мооге С. et al., 1988].
Африканский малярийный комар был завезен в Бразилию приблизительно в 1929 г. Хотя малярийный паразит уже был в Бразилии, новый переносчик существенно расширил границы малярийных очагов и увеличил число случаев болезни. Так как он не смог приобрести необходимую в Южной Америке темно зеленую окраску, то постепенно был элиминирован. Однако, по различным оценкам, от перенесенной им малярии погибло до 20 тыс. человек [Wilson M., 1995].
Распространение инфекций самолетами. Артроподы способны перенести самые тяжелые условия воздушного путешествия. Опытным путем было установлено, что они прекрасно выживают при длительном полете при температуре — 42°С в колесах Боинга 747В. В 12 из 67 самолетов, прилетевших в Лондон из тропических стран, были обнаружены москиты [Russell R., 1987]. По этой причине, из переносимых москитами инфекционных болезней, в неэндемических районах наиболее часто встречается «малярия аэропортов» [Morse S., 1995].
Распространение инфекций наземным транспортом. Переносчик африканского трипаносомоза Glossina palpalis, неспособен проделать путь, превышающий 21 км, однако, благодаря наземному транспорту он распространяется на значительно большие расстояния [Wilson M., 1995].
Распространение инфекций экзотическими животными. Семь человек в г. Марбург (Германия) погибли от геморрагической лихорадки, вызванной инфицированием от угандийских обезьян вирусом, в последствии, получившем название этого города. Отмечены внутри лабораторные заражения людей герпесвирусом В от обезьян и геморрагической лихорадкой с почечным синдромом от грызунов [Wilson M., 1995].
Технологии и индустрия. Быстродействие характеризует не только туризм, но и другие индустрии современного мира. Технологии, применяемые для производства продуктов питания и других продуктов биологического происхождения, как правило, эффективны и недороги, но их использование одновременно увеличивает риск случайной контаминации и приводит к многократному усилению последствий такой случайности. Медицинские назначения — также передняя линия экспозиции людей к возбудителям новых инфекционных болезней. Проблема усугубляется глобализацией, позволяющей микроорганизму распространяться на очень большие расстояния [Morse S., 1995].
Увеличению числа новых инфекционных болезней способствует и улучшение технологий их диагностики. Оказывается, что с возбудителями многих из них мы давно уже знакомы. Проблемой являются условия, при которых их эпидемическая значимость повышается. Ниже мы рассмотрим механизмы появления и распространения новых инфекций препаратами крови, в стационарах и продуктами питания.
Препараты крови. Препараты крови обычно подвергаются контролю, считается, что они не опасны. Однако насколько эффективен этот контроль? И что же, все-таки, контролируется в крови доноров? Поищем ответ на эти вопросы на примере возбудителей инфекций, использующих вторую стратегию паразитизма.
В настоящее время основным способом выявления ВИЧ-инфекции является обнаружение в периферической крови иммуноглобулинов против антигенов вируса (в основном протеинов и гликопротеидов gp 120, gp41, p24). Но так можно диагностировать ВИЧ и другие ретровирусы (например, возбудителей лейкоза HTLV 1, 2) лишь после сероконверсии. Если исследуемый донор инфицирован высокоэкспрессивным штаммом, антитела возникают относительно быстро — до 3 мес. Но «молчащая инфекция» таким способом не выявляется (Медников Б.М., 1993). Насколько эта проблема серьезна, говорят данные сравнительного исследования иммунологическими методами и ПЦР детей, родившихся от ВИЧ-инфицированных матерей.
Как следует из результатов N. Shaffer и соавт. (1992), после рождения ребенка антитела в его крови появляются через месяц у 60% испытуемых (рис. 44). Далее, на втором месяце, число серопозитивных младенцев становится ниже 40%. Это соответствует первой стадии иммунного ответа, когда иммуноглобулины, связываясь с вирусом, «захватываются» макрофагами и продолжают инфицировать организм. В результате после 6 месяцев жизни ребенка сероконверсия достигает только 70%.
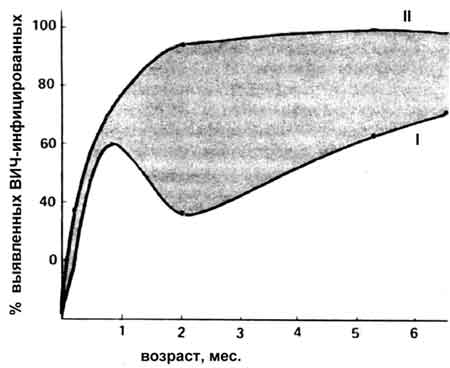
Рис. 44. Несоответствие результатов иммунной реакции данным ПЦР-анализа при обнаружении людей, инфицированных ВИЧ. Диагностика ВИЧ-инфекции у детей, родившихся от ВИЧ-инфицированных матерей. I — положительный ответ в иммунной реакции, II — в цепной полимеразной реакции [Shaffer N. et al., 1992]. Следовательно, применяемые в повседневной практике иммунологические методы обнаружения ВИЧ не выявляют до трети ВИЧ-инфицированных!
Положительный ответ в ПЦР с момента рождения ребенка неуклонно возрастает, доходя до 100% к 6 мес. Из этого следует не только факт передачи ВИЧ от матери к плоду через плаценту. Это означает и то, что, по меньшей мере, каждый третий (!) инфицированный ВИЧ не выявляется стандартными иммунологическими методами, а значит, согласно ныне принятой медицинской диагностике может вести без всяких предосторожностей половую жизнь и быть донором [Медников Б.М., 1993]. Заметим, что до сегодняшнего дня нет удовлетворительных иммунологических тестов и на ВИЧ-1 группы О [Chemberland et al., 1998]. Этих нерешенных проблем вполне достаточно, чтобы эпидемия СПИДа поддерживалась и усугублялась гемотрансфузиями.
Та же ситуация с выбраковкой крови лиц, инфицированных возбудителями сывороточных гепатитов. Основная часть хронического носительства, по мнению А.Ф. Блюгера (1989), формируется в результате эмбрионального «привыкания» к антигенам возбудителя, если беременная женщина является носителем вируса. Лимфоциты плода вступают в контакт с антигеном вируса как с материнским антигеном. Поэтому в течение всей жизни человека он уже не воспринимается ими как чужеродный, и антитела на него не вырабатываются. Антитела к возбудителю сывороточного гепатита могут отсутствовать и при различных сопутствующих иммунодефицитных состояниях, не явных для клиницистов. Например, у больных с лейкозами [Константинова Т.С. и др., 1996], алкогольным и аутоиммунным гепатитами [Ryo F. et al., 1996]. Видимо та же ситуация имеет место при других приобретенных и врожденных иммунодефицитных состояниях.
Выбраковка серопозитивной крови при инфицировании популяции потенциальных доноров, создает условия для селекции из неоднородной популяции мутантов штаммов возбудителей, вызывающих эти же инфекции, но без сероконверсии. F. Ryo и соавт. (1996), показали, что большинство (86%) серологически «глухих» «ни В, ни С» гепатитов, вызываются штаммами вируса гепатита В с делецией 8 нуклеотидов в дистальной части области X генома. Эти мутации формируют трансляционный стоп-кодон, который укорачивает белок X на 20 аминокислот с С-терминального конца. У всех HBV-ДНК также имелась предкоровая мутация у 83-го нуклеотида, что приводило к повреждению синтеза HBeAg и антитела к нему не находили стандартными методами. Следовательно, после изъятия крови сероконвертантов, преимущества в эпидемической цепи получают несероконвертирующие штаммы вируса гепатита В. И мы снова попадаем в растянутую во времени петлю обратной связи.
Возбудители инфекций, использующие стратегию паразитизма II типа, существуют вне наших представлений о времени, поэтому никого не должны обманывать низкие величины обнаружения инфицированных тем или иным паразитом порций донорской крови. У этих паразитов имеется, как правило, возможность использовать другие пути для смены хозяина, например, половой. Эпидемические цепочки паразитов, внесенных в какую-то человеческую популяцию посредством даже единичных гемотрансфузий, будут поддерживаться неограниченно долго, приводя к инфицированию все большего количества людей. Прежде всего, это относится к ВИЧ, вирусам герпеса, цитомегаловирусам, человеческим Т-клеточным лимфотропным вирусам, вирусам сывороточных гепатитов и микоплазмам. Однако, куда более опасная ситуация может возникнуть в отношении паразитов с третьей стратегией паразитизма. Если в отношении возбудителей, использующих вторую стратегию, мы хотя бы думаем, что знаем ситуацию, то в отношении паразитов с третьей стратегией, мы вообще об этой ситуации не задумываемся.
Новые инфекции в стационарах. Сегодня мы можем утверждать, что наблюдаем бесконечный парад внутрибольничных инфекций, когда после прохождения одной колонны внутрибольничных патогенов, шествует другая, еще более опасная. Если в XIX столетии, во времена «до Земмельвейса» (тогда хирурги мыли руки после операции, а не перед ней), основной нозокоминальной инфекцией был стрептококк А, то к средине XX столетия его из стационаров вытеснил относительно устойчивый к средствам антисептики S. aureus фаготипа 94/96. Под воздействием антибиотиков первого поколения стафилококк «уступил» в 1970-х гг. свое место Pseudomonas aeruginosa и Enterobacteriaceae. В течение 1980-х гг. и в начале 1990-х гг. новые поколения антибиотиков (цефалоспорины, ванкомицин) обеспечили в стационарах некоторую передышку. Однако появившиеся в эти же годы метициллинрезистентные S. aureus (MRSA) и ванкомицинрезистентные энтерококки (VRE), свидетельствовали о предстоящем изменении ситуации. В средине 1990-х гг. в стационарах прочно обосновались три группы грамположительных патогенов — S. aureus (преимущественно MRSA), коагулазоотрицательные стафилококки и энтерококки, вместе вызывающие до 34% всех внутрибольничных инфекций; и четыре группы грамотрицательных патогенов — E. coli, P. aeruginosa, Enterobacter и Klebsiella pneumoniae, вызывающие до 32% внутрибольничных инфекций [Weinstein R., 1998]. Как правило, все они представлены антибиотико-резистедатными штаммами.
Развитию ситуации во многом поспособствовал новый способ передачи возбудителей инфекционных болезней в стационарах, названный Е.П. Ковалевой (1995) артифициальным (от лат. artificial — искусственный), обеспечиваемый различными видами медицинского вмешательства (табл. 20).
Таблица 20
Артифициальный механизм передачи и связанные с ним инфекции*
| Процедуры | Передаваемые инфекции |
|---|---|
| Забор крови | ВИЧ-инфекция, гепатиты В, С, Д, инфекции, вызываемые грамотрицательными бактериями, стафилококками |
| Зондирование желудка, двенадцатиперстной кишки, тонкого кишечника | Геликобактериоз, ВИЧ-инфекция, гепатиты В, С, Д (при травмировании слизистой) |
| Эндоскопии | |
| Бронхо- | Псевдомонозы, клебсиеллезы, стафилококковая инфекция, пневмоцистоз, гепатиты В, С, Д Геликобактериоз Инфекции, вызванные грамотрицательными бактериями Кишечные бактериальные и вирусные инфекции |
| Трахео- | |
| Гастро- | |
| Цисто- | |
| Ректо- | |
| Пункции | |
| Люмбальные | ВИЧ-инфекция; гепатиты В,С,Д; цитомегалия; инфекции, вызываемые грамотрицательными бактериями; стафилококковая и стрептококковая инфекции |
| Лимфоузлов | |
| Органов | |
| Получение биоптатов | |
| Тканей | ВИЧ-инфекция; гепатиты В,С,Д; цитомегалия; инфекции, вызываемые грамотрицательными бактериями; стафилококковая и стрептококковая инфекции; анаэробные инфекции, кандидоз |
| Органов | |
| Мануальное обследование | |
| Вагинальное | Трихомониаз, грибковые болезни, ВИЧ-инфекция, гепати ты В, С, Д, цитомегалия |
| Ректальное | |
| Трансфузии | |
| Крови | Гепатиты В, С, Д; ВИЧ-инфекция; цитомегалия; сифилис; листериоз; токсоплазмоз; герпетическая инфекция; малярия |
| Плазмы | |
| Инъекции | |
| Подкожные | Гепатиты В, С, Д; ВИЧ-инфекция; цитомегалия; стафилококковая и стрептококковая инфекции; инфекции, вызываемые грамотрицательными бактериями |
| Внутрикожные | |
| Внутримышечные | |
| Внутривенные | |
| Внутрикостные | |
| Трансплантации | |
| Тканей | Гепатиты В, С, Д; ВИЧ-инфекция; цитомегалия; стафилококковая и стрептококковая инфекции; инфекции, вызываемые грамотрицательными бактериями Стафилококковая инфекция, инфекции, вызываемые грамотрицательными бактериями, кандидоз, токсоплазмоз |
| Органов | |
| Костного мозга | |
| Операции | Стафилококковая инфекция, инфекции, вызываемые грамотрицательными бактериями, анаэробные инфекции, кандидоз, гепатиты В, С, Д, ВИЧ-инфекция |
| Катетеризация | |
| Сосудов | Инфекции, вызываемые грамотрицательными бактериями, гепатиты В, С, Д, ВИЧ-инфекция, сифилис |
| Мочевыводящих путей | |
| Интубация | Псевдомоноз, стафилококковая и стрептококковая инфекции |
| Гемодиализ | Стафилококковая инфекция, инфекции, вызываемые грамотрицательными бактериями, анаэробные инфекции, гепатиты В, С, Д, ВИЧ-инфекция |
| Искусственная вентиляция легких | Инфекции, вызываемые грамотрицательными бактериями, гепатиты В, С, Д, ВИЧ-инфекция, сифилис |
| Использование аппаратуры искусственного кровообращения | Стафилококковая инфекция, инфекции, вызываемые грамотрицательными бактериями, анаэробные инфекции, гепатиты В, С, Д, ВИЧ-инфекция |
| Ингаляции лечебных аэрозолей | Легионеллезы, инфекции, вызываемые грамотрицательными бактериями, стафилококковая и стрептококковый инфекции |
| Лечебные души, ванны, плавание в бассейне | Легионеллезы, псевдомонозы, инфекции, вызываемые грамотрицательными бактериями, грибковые болезни |
* По Е.П. Ковалевой, 1995.
Среди многочисленных примеров артифициальной передачи есть вторичные случаи инфекций при вспышках лихорадки Эбола в африканских больницах, где вирус был перенесен другим пациентам через контаминированные инструменты; и персоналу в результате контактов с первичными больными. Аналогичные случаи инфицирования работников здравоохранения были описаны для лихорадки Лаоса [Morse S., 1995].
Если раньше ввести паразитический организм в кровь человека мог только артропод-переносчик, а взаимодействие между этим переносчиком, паразитом и человеком строились в течение миллионов лет совместной эволюции, то инвазивные лечебные и диагностические процедуры в XX столетии стремительно вовлекли в инфекционные процессы микроорганизмы, к которым организм человека эволюционно оказался неподготовленным. Первоначально последствия артифициальной передачи «приглушались» мощными антибиотиками. Но на протяжении жизни одного поколения людей эти антибиотики стали неэффективными.
Например, у двух штаммов возбудителя дизентерии, обнаружены плазмиды, кодирующие новые дегидрофолатредуктазы. Микроорганизмы, содержащие гены этих ферментов, устойчивы к такому количеству сульфониламида триметоприма, которое вообще невозможно создать в органах и тканях организма человека [Barg N.L. et al., 1990]. Исследователями из Fujisawa Pharm. Co., Ltd. (Япония) уже более 10 лет назад обнаружена плазмидообусловленная оксииминоцефалоспориназа из E. coli. Фермент гидролизует современные цефалоспорины: цефуроксим, цефотаксим, цефменоксим, цефтриаксон, цефалоридин, цефотиам, цефпирамид [Yoshimi М. et al., 1988]. Из хромосомы S. marcescens осуществлено клонирование нового гена 6'-N ацетилтрансферазы АА(6'), обеспечивающего устойчивость к действию аминогликозидов нетилмицина и амикацина [Champion H. et al., 1983]. За три года до этих экспериментов, амикацин считался устойчивым к действию всех аминогликозидмодифицирующих ферментов [Bryan L., 1980].
Показана возможность передачи конъюгацией гена устойчивости к ванкомицину между энтерококками. Появление этой устойчивости было связано с синтезом в бактериальной клетке нового мембранного белка [Thalia N. et al., 1989]. Ранее подобный механизм устойчивости к ванкомицину считался невозможным [Bryan L., 1980].
Однако ситуация изменилась не только в сторону наращивания числа полирезистентных бактериальных штаммов в стационарах, т.е. количественно. С начала 1990-х гг. она стала меняться качественно. Это проявилось ростом числа случаев инфицирования иммунокомпромиссных больных вирусными и грибковыми патогенами либо относительно устойчивыми к лечебным препаратам, либо эти препараты у таких больных оказывались бесполезными.
Принципиально новым моментом в данной ситуации стали инъекционное введение препаратов, полученных их тканей других биологических видов, а также органные трансплантантации и ксенотрансплантации, окончательно сломавшие межвидовые барьеры, которые природа возводила миллионы лет. В качестве примера рассмотрим ятрогенное инфицирование людей возбудителем болезни Крейцфельдта—Якоба.
Болезнь Крейцфельдта—Якоба ( CJD ). Вызывается прионовым белком. Хотя впервые болезнь описали в 1920-х гг., ее инфекционная природа стала известна только 1966 г. На сегодняшний день описано более 100 случаев инфицирования людей CJD в медицинских учреждениях (табл. 21).
Таблица 21
Инфицирование в медицинских учреждениях прионом — возбудителем CJD*
| Способ инфицирования | Кол-во больных | Проникновение агента в мозг | Средний инкубационный период (интервал) |
|---|---|---|---|
| ИНСТРУМЕНТАЛЬНЫЙ | |||
| Нейрохирургия | 4 | Интрацеребрально | 20 мес (15–28) |
| Введение электродов | 2 | То же | 18 мес (16–20) |
| ПЕРЕНОС ТКАНЕЙ | |||
| Роговичный трансплантант | 2 | По оптическому нерву | 15 мес (16–18) |
| Твердая мозговая оболочка | 25 | С поверхности мозга | 5,5 лет (1,5–12) |
| ПЕРЕНОС ТКАНЕВЫХ ЭКСТРАКТОВ | |||
| Гормон роста | 76 | Гематогенно | 12 лет (5–30) |
| Гонадотропин | 4 | То же | 13 лет (12–16) |
* По М. Rickett и соавт., 1998.
Приведенные в табл. 21 данные не охватывают всех случаев внутрибольничного инфицирования CJD. Недавно в Японии было описано еще 40 случаев передачи болезни через пересаженную твердую мозговую оболочку [Rickett M. et al., 1998]. Возбудитель болезни крайне устойчив к используемым в клинической практике дезинфектантам и не обнаруживается до развития симптомов, т. е. от 15 месяцев до 30 лет. Эпидемическая передача прионов с кровью пока не доказана, однако получены экспериментальные доказательства такой возможности [Rickett M. et al., 1998]. Это открывает CJD и другим прионным болезням возможность стать в XXI столетии рядовыми нозокоминальными инфекциями, какими сейчас являются сывороточные гепатиты и СПИД, а в XIX столетии были стрептококковые гнойные инфекции.
По мнению R. Weinstein (1998), так мы стали входить в «постантибиотиковую эру». Добавлю — микроорганизмы из «доантибиотиковой» и «антибиотиковой», также идут туда с нами.
Опасные эксперименты. Это явление связано с поведением людей, получившим доступ к современным технологиям молекулярной» биологии и трансгенной инженерии. Опасность таких экспериментов заключается в непредсказуемости их отдаленных результатов. Например, в экспериментах, проводившихся на кроликах и мышах сотрудниками компании Bionetics Research Inc. (США) изучалась возможность взаимодействия ВИЧ с вирусом лейкемии мышей Ми LV, который обладает тропизмом ко многим тканям. При совместном инфицировании животных обоими вирусами возросло цитопатогенное действие ВИЧ. Данное явление обусловлено образованием псевдотипов вируса, содержащих в своем составе геномы обоих вирусов. При репликации таких псевдотипов появляются вирусные частицы, способные инфицировать клетки, лишенные специфичного для ВИЧ рецептора CD4 и обладающие тропизмом вируса лейкемии мышей [Therre H., 1990]. В сходных экспериментах Takeucyi и соавт. также расширили специфичность вируса. Ими создана мутантная линия ВИЧ, поражающая фибробластоподобные клетки мозговой ткани человека, не несущие CD 4 рецептор (цит. по статье P. Dimond, 1990). Кроме усугубления тяжести инфекционного процесса, наиболее опасным следствием таких экспериментов может стать создание ретровирусов, использующих наследственный механизм передачи. В этом случае вирус будет существовать столько, сколько и реципиентный вид.
Гибрид ВИЧ и вируса иммунодефицита обезьян, способный вызывать модельную инфекцию у обезьян, был получен в США с помощью генно-инженерных методов [Cohen J., 1992]. Во многих странах создаются трансгенные животные различных видов с иммунной системой человека, обладающие способностью поддерживать персистирование ВИЧ и его производных [Therre H., 1990]. По своей сути они являются искусственными резервуарами ретровирусов человека. Весьма показательно то, что исследователи из Национального института рака (США) и Гарвардского университета (США), независимо друг от друга, создали новые варианты ВИЧ, способные передаваться человеку от некоторых трансгенных мышей, используемых для изучения СПИДа. Эти вирусы, «захватывая» молекулярные фрагменты других вирусов, приобретают повышенную инфекционность. К сожалению, нет никаких международных соглашений, ограничивающих эти эксперименты или хотя бы, предполагающие международный контроль, как это имеет место в отношении возбудителей особоопасных инфекций — потенциальных агентов биологического оружия.
Пищевые технологии. Эпидемиология пищевых инфекций быстро меняется. С пищей в человеческие популяции проникают возбудители новых инфекций, масштабы вспышек достигают небывалых размеров. Даже в такой развитой стране как США, ежегодно через продукты питания инфицируются от 6 до 80 млн. человек, из которых до 9 тыс. гибнет (табл. 22).
Таблица 22
Среднее количество заболевших и умерших от пищевых инфекций в США за год*
| Патоген | Количество случаев (103) | Кол-во смертельных исходов (103) | Продукты питания |
|---|---|---|---|
| Campylobacter jejuni | 4000 | 0,2–1 | Домашняя птица, сырое молоко, необработанная вода |
| Salmonella (не тифоидная) | 2000 | 0,5–2 | Яйца, домашняя птица, мясо, свежие продукты, другие сырые продукты |
| Escherichia coli 0157:Н7 | 725 | 0,1–0,2 | Говядина, сырое молоко, салат-латук, необработанная вода, непастеризованный сидр |
| Listeria monocytogenes | 1,5 | 0,25–0,5 | Мягкий сыр, паштет, гастрономические продукты |
| Vibrio sp. | 10 | 0,05–0,1 | Морепродукты |
*По S. Altekruse и соавт. (1997).
Ущерб от пищевых инфекций оценивается в 5 млрд. долларов в год [Altekruse et al., 1997]. Появлению новых пищевых инфекций способствуют многие взаимосвязанные факторы.
Изменение поведения человека. Люди все меньше питаются дома, все больше в общественных местах. Благодаря концентрации переработки пищи, увеличивается масштабность последствий технологических ошибок. Вспышки такого типа составляли в 1990-х гг. до 80% пищевых инфекций в США [Collins J. et al., 1995]. Другой причиной проникновения новых инфекций является увеличение потребления свежих фруктов и овощей. Такие продукты часто оказываются инфицированными фекалиями людей и животных. Кроме того, растительные продукты сами могут являться природным резервуаром возбудителей очень многих опасных инфекций (см. «почвенный резервуар»). Произведенные продукты свозятся на общие склады, где при нарушениях технологий хранения присутствующие в них в небольших количествах микроорганизмы, начинают активно размножаться. При нарушениях технологии приготовления пищи создаются условия для инфицирования сразу больших количеств людей. Это происходит из-за того, что патоген, попавший в сырье, может оказаться в конечном продукте, как это произошло с гамбургерами, контаминироваными штаммом кишечной палочки, вызывающим гемолитический уремический синдром. В Соединенных Штатах, благодаря такому механизму, широко распространилась кишечная палочка серотипа 0157:Н7. Подобные серотипы E. coli идентифицированы и в других странах [Altekruse et al., 1997].
Изменения технологий разведения домашних животных и приготовления пищи. Прежде всего, играет свою роль чрезмерная централизация сельскохозяйственного и животноводческого производства. Вспышка сальмонеллеза в 1985 г. в США, вызванная контаминированным молоком, оценивается в 250 тыс. заболевших [Ryan С. et al., 1987]. Недавнее появление в Великобритании нового заболевания крупного рогатого скота — бычьей спонгиформной энцефалопатии, связано с передачей от овец разновидности возбудителя скреппи. Оно стало возможным из-за ошибок в технологическом процессе при централизованной подготовке кормов, получаемых из погибших овец — возбудитель скреппи не был полностью инактивирован [Morse S., 1995]. Другой пример — увеличение птицехозяйств. Если еще несколько десятилетий назад птичники редко насчитывали более 500 птиц, то в 1995 г. нормой стало содержание 100 тыс. птиц [Bell D., 1995]. Это серьезно обострило проблему сальмонеллеза, так как затруднило контроль над здоровьем поголовья и стерильностью яиц. Возбудитель, однажды попавший в содержащееся в таком огромном птичнике поголовье, уже практически невозможно из него элиминировать — кроме вертикальной передачи, он постоянно будет поддерживаться грызунами и в птичьем помете [Altekruse et al., 1997].
Среди причин, способствующих появлению новых пищевых инфекций, называют международные перевозки, микробную адаптацию и др. (табл. 23).
Таблица 23
Отдельные вспышки новых пищевых инфекций в США и вызвавшие их причины*
| Патоген/вспышка | Год | Способствовавшие факторы |
|---|---|---|
| Гепатит А. Замороженная клубника | 1997 | Международные перевозки, коммерция, технологии и индустрия |
| Salmonella tiphimurium DT 104. Посещение фермы | 1996 | Микробная адаптация |
| Cyclospora cayetanensis Малина из Гватемалы | 1996 | Международные перевозки и коммерция |
| Salmonella enteritidis PT 4 Продукты, содержащие яйца | 1995 | Международные перевозки, коммерция, технологии и индустрия |
| Salmonella enteritidis Распространение инфицированного сливочного мороженного | 1994 | Технологии и индустрия |
| Норвалк-подобный вирус Морские устрицы | 1994 | Экономическое развитие и использование земли |
| Escherichia coli O157:H7 Плохо приготовленный гамбургер | 1993 | Технологии и индустрия Нарушения в общественном здравоохранении |
| Escherichia coli O157:H7 Сырой яблочный сидр | 1991 | Изменения демографии и поведения человека Технологии и индустрия |
| Vibrio cholerae Ol, El Tor Тайское кокосовое молоко | 1991 | Международные перевозки и коммерция Изменения демографии и поведения человека |
| Trichinella spiralisНедоваренная свинина | 1990 | То же |
| Salmonella cheater Ломтики мускусной дыни | 1989 | То же |
| Yerginia enterocolitica Свинной рубец | 1988 | Изменения демографии и поведения человека |
* По S. Altekruse и соавт. (1997).
На примере E. coli 0157:H7 и ботулинуса мы рассмотрим каким образом проникают такие возбудители в высокотехнологичные пищевые продукты. Кроме того, ботулинический микроб еще наглядно демонстрирует роль микробной адаптации в этом процессе.
E . coli 0157:Н7. Штамм распознан как человеческий патоген в 1982 г., после двух вспышек в США, связанных с употреблением недоваренных гамбургеров в пункте быстрого питания. В течение пятнадцати лет после 1982 г. в США было зарегистрировано до 60 крупных вспышек, вызванных E. coli O157:H7 [Acheson D., Keusch G., 1996]. Ежегодно в США от геморрагического колита и гемолитического уремического синдрома, вызываемого данным возбудителем, гибнет до 250 человек [Altekruse et al., 1997]. В основе патогенного действия E. coli 0157:H7 лежит его способность продуцировать цитотоксин, сходный по свойствам с цитотоксинами шигелл. В мире существует много различных серотипов кишечных палочек, синтезирующих шигаподобные токсины и вызывающие диареи с аналогичным симптомокомплексом. Их называют энтерогеморрагическими E. coli (EHEC).
E. coli 0157:H7 имеет низкую для человека инфицирующую дозу — порядка нескольких сот микроорганизмов. Основным резервуаром E. coli 0157:Н7 и других ЕНЕС считается рогатый скот. Хотя ЕНЕС обычно не вызывает болезнь у животных, эти микроорганизмы в большом количестве находят в их фекалиях. Высвобождение ЕНЕС при убое считают основным путем, посредством которого они проникают в пищевые продукты. Меры предосторожности мало эффективны, когда дело касается продуктов из измельченной говядины, поскольку их готовят из мяса, полученного от многих животных. Таким образом, даже если инфицировано одно животное, бактерии проникают во всю партию [Acheson D., Keusch G., 1996].
E. coli 0157:H7 и другие ЕНЕС крайне «технологичны». Современная пищевая промышленность дает им хорошую возможность закрепиться в человеческой цивилизации. Кроме измельченной говядины, ЕНЕС передаются в приготовленных методами сухой ферментации колбасных изделиях, молоке, яблочном сидре, майонезе и различных салатах. Кроме того, они используют традиционные пути передачи — через воду и прямой контакт от человека к человеку, и от рогатого скота к человеку. Однако в большинстве случаев источником инфекции для людей является рогатый скот [Acheson D., Keusch G., 1996].
Необычные нейротоксигенные клостридии. Возбудитель ботулизма C. botulinum является наиболее известным пищевым патогеном. Увеличению количества случаев отравления ботулиническим токсином способствуют плохая термическая обработка консервированной пищи и ее хранение при недопустимых температурах. Однако, как оказалось, C. botulinum не единственный микроорганизм, способный вызывать ботулизм. В фекалиях больных ботулизмом обнаружены и затем из них выделены другие организмы, продуцирующие ботулотоксин В. Этот токсин требовал большого количества антитоксина для его нейтрализации. В двух случаях токсин нейтрализовался только смесью антитоксинов В и F. В четырех случаях возбудителями оказались токсичные штаммы C. barati, С. butyricum [Hathewey C.L., Vc Croskey L.M., 1989]. Оба микроорганизма никогда не считались патогенными и широко использовались в пищевой промышленности. Атипичные вспышки ботулизма описаны в Италии, Китае и Индии [Chaudhry R. et al., 1998]. Эти данные позволяют предположить, что происходит глобальное распространение ботулинических tox-генов в популяциях близкородственных микроорганизмов, сопровождающееся появлением новых серотипов токсинов.
Улучшение диагностики. Положительной стороной прогресса являются достижения диагностических технологий, позволяющие распознавать инфекционный агент, после того как он приобрел широкое распространение. Если такой возбудитель описан недавно, неверно делать вывод, что он является причиной новой инфекционной болезни (гиперссылка на статью «Мифы СПИДа»). Человеческий герпесвирус VI типа (HHV-6) был идентифицирован только несколько лет назад, но вирус оказался необычайно широко распространенным. Недавно было показано, что инфицирование HHV-6 вызывает давно известную педиатрам болезнь — розеолу (exanthem subitim). Так как розеола была известна, по крайней мере с 1910 г., то, вероятно, что HHV-6 существовал намного дольше. Ещё один новый пример — бактерия Helicobacter pilori, вероятная причина язвы желудка и отдельных онкологических болезней. Мы жили с этими болезнями в течение длительного времени, но не знали их причину [Morse S., 1995].
Микробные адаптация и изменения. Микробы, подобно всем другим живым организмам, постоянно эволюционируют, образуя новые эпидемические варианты, либо изменяя патогенез вызываемой ими инфекционной болезни. По мнению J. Lederberg (1997), одновременно происходит сложный процесс коэволюции очень многих живых организмов, включающий слияние, объединение, бифуркацию и повторное появление новых видов. Различные эволюционные явления могут происходить в любой сдвоенной ассоциации с непредсказуемыми результатами (табл. 24).
Таблица 24
Предпосылки генетической эволюции микроорганизмов*
| Микроорганизмы (бактерии, вирусы, грибы, протозоа) — быстрая и непрерывная эволюция, высокая плотность популяций и время генерации в пределах нескольких минут: |
|---|
| а) интраклональный процесс: |
| репликация ДНК сопровождается мутагенезом, вызванным солнечным светом, химическими веществами (включая имеющиеся в природе); |
| для репликации РНК характерно большое количество ошибок; гаплоидность — немедленное проявление новых признаков, при этом, из-за участия в генетическом обмене плазмид, не накапливается частичная рецессивность; амплификация; |
| сайт направленные инверсии и транспозиции (фазовые вариации признаков); |
| другие специфически вовлеченные механизмы: геномная дупликация, сплайсинг; |
| б) интерклональный процесс: |
| беспорядочная рекомбинация, не все механизмы которой известны; конъюгативный процесс между тысячами видов; |
| универсальность вирусной трансдукции и лизогенной интеграции (классический пример — фаговая трансдукция токсигенности у С. diphtheriae); плазмидный обмен генами и интеграция (токсины B. Anthracis) |
| индуцированная химическими веществами реассортация и рекомбинация геномов РНК-вирусов; |
| бактерии и вирусы способны подбирать гены хозяев (антигенная маскировка?); |
| обмен генами между царствами: P. tumefaciens и растения, Е. coli и дрожжи |
*По J. Lederberg (1997)
Появление антибиотико-устойчивых микроорганизмов — эволюционный урок, демонстрирующий мощь демона Дарвина. Селекция антибиотико-резистентных бактерий и лекарственно-устойчивых паразитов часто не соответствует используемым препаратам. Патогены могут «приобретать» новые гены резистентности и для того, чтобы сохраниться в природе среди непатогенных видов. Здесь они селекционируются, а возможно даже и создаются давлением антибиотиков соперничающих видов [Morse S., 1995].
Многие вирусы обладают способностью мутировать и благодаря этому постоянно образуют новые эпидемические и эпизоотические варианты. Наглядный пример — эпидемический вирус гриппа А.
Образование новых эпидемических вариантов вируса гриппа. Вирус гриппа отличается от других респираторных вирусов своей способностью к значительным антигенным вариациям. Оба поверхностных антигена вируса гриппа подвержены двум типам вариаций: дрейфы и шифты. Антигенный дрейф заключается в минимальном изменении гемагглютинина и нейраминидазы, вызванном точечными мутациями в их генах. Антигенный шифт сопровождается значительными изменениями этих молекул, что является следствием замены сегментов их генов. Регулярные эпидемии вызваны «антигенным дрейфом» ранее уже циркулирующих вирусов гриппа. Изменения происходят в антигенных сайтах их поверхностных протеинов, обычно гемагглютинина, позволяя новым вариантам реинфицировать ранее инфицированных людей, так как из-за изменения антигенов вируса, он не распознаётся иммунной системой хозяина. Пандемии гриппа вызываются «шифтовыми» штаммами, и их появление трудно предугадать [Morse S., 1995].
Считается, что природным резервуаром вируса гриппа А является водоплавающая птица, но возможно, что он поддерживается в природе среди водных простейших. Вирус реплицируется в клетках кишечного тракта уток и попадает в воду с их фекалиями. Молодняк инфицируется и разносит вирус по всему миру, передавая его домашней и одичавшей птице. Через контаминированную фекалиями воду и используемые для кормления животных птичьи тушки и потроха, вирус гриппа А инфицирует свиней и лошадей. Далее основным путем его передачи становится респираторный (рис. 45).
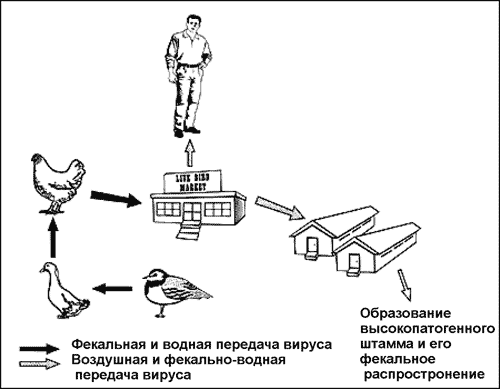
Рис. 45. Появление вируса гриппа H5N1 в Гонконге. Непатогенный штамм вируса поддерживался ржанками и через контаминированную воду был передан уткам. От них он попал в выводки цыплят и вместе с ними обосновался на гонконгском рынке живой птицы. Передаваясь между различными видами, вирус приобрел патогенность для цыплят и случайно проник в человеческую популяцию. Будучи высоко патогенным для цыплят и для отдельных (!) людей, вирус остался непатогенным для уток и гусей [Webster R., 1998].
Данные, полученные R. Webster и соавт. (1992), также показывают то, что утки являются только главным резервуаром вируса, а роль «смешивающего сосуда», в котором формируется новый для млекопитающих вирусный штамм, играют домашние свиньи. Стало понятно, почему вообще все пандемические вирусы гриппа прибывали из Китая. Объединение в сельском хозяйстве уток и свиней, представляющее собой чрезвычайно эффективную систему производства продовольствия и столетиями традиционно осуществляемая в некоторых регионах Китая, создавало естественную лабораторию для получения новых рекомбинантов вируса гриппа. R. Webster и соавт. (1992) также предположили, что условия для рекомбинации вирусов могут сегодня существовать и в некоторых высокоинтенсивных хозяйствах Европы.
Любопытно то, что птичий вирус гриппа, циркулирующий среди водоплавающей птицы, удивительно стабилен. За последние 60 лет неполучено доказательств его эволюции. Такой высокий консерватизм свидетельствует о достижении им определенного оптимума в природном резервуаре, при котором любые нуклеотидные замены не создают вирусу никаких дополнительных преимуществ. Но это также свидетельствует и о том, что предковый вирус, ставший причиной пандемий «испанки» в 1918 г., азиатского гриппа 1957 г. и гонконгского гриппа 1968 г., продолжает поддерживаться в природном резервуаре, и будет поддерживаться еще неограниченно долго [Webster R, 1998].
Образование новых эпидемических вариантов гепатита В. Возбудитель болезни, вирус гепатита типа В (HBV), выявлен сравнительно недавно, в 1970 г. Хотя типы нуклеиновых кислот у него и ВИЧ различны, исследователями отмечается общее сходство структуры геномов обоих вирусов. У HBV ДНК реплицирует как и у ретровирусов — с использованием обратной транскриптазы. В мире по далеко не полным данным, болеют хроническими формами гепатита В более 300 млн. человек. Ежегодно возникает до 1 млн. новых случаев. Несмотря на быстрый прогресс в конструировании вакцин и проведение в ряде стран широкомасштабных программ иммунизации против гапатита В, сохраняется тенденция к его глобальному распространению [Тиолле П., Буэндиа М., 1991].
Попробуем понять, какие последствия массовой иммунизации в отношении вируса гепатита В могут проявиться в XXI веке.
Распространенность и длительность персистентной инфекции HBV позволяет этому вирусу сохраняться в значительно меньших изолированных неиммунизированных группах населения, чем это необходимо, например, для поддержания вирусов натуральной оспы и гриппа. Однако основная часть хронического носительства вируса формируется в результате эмбрионального «привыкания» к антигенам возбудителя, если беременная женщина является носителем вируса [Блюгер А.Ф., 1989].
Кроме того, отчетливо выражена этническая «разборчивость» вируса, затрудняющая полную ликвидацию его очагов в Юго-Восточной Азии и особенно в Африке. Так же обнаружено то, что показатель положительных серологических реакций на введение вакцины у взрослых африканцев значительно ниже такого же показателя среди взрослых в западных странах, получивших ту же вакцину в такой же дозе [Тиолле П., Буэндиа М., 1991]. Следовательно, иммунизация в принципе не в состоянии решить проблему распространения гепатита В, какого бы типа не использовалась вакцина.
В последние годы существенно изменились первоначальные представления об исключительном сродстве вируса к гепатоцитам. Оказалось, что он способен встраиваться в геномы лимфоцитов, моноцитов, клеток эндотелия сосудов, эпителиальных клеток кожи, поджелудочной железы и даже сперматозоидов [Блюгер А. Ф., 1989].
Теперь посмотрим, что же происходит с вирусом гепатита В в организме, иммунизированном плазменными или генно-инженерными вакцинами.
Наиболее иммуногенным компонентом таких вакцин является рrе-s2участок поверхностного антигена вируса. Он представляет собой рецептор к особому белку сыворотки крови человека — полимеризованному альбумину. Аналогичный рецептор есть на гепатоцитах. Поэтому альбумин притягивает вирус к клеткам печени и тем самым, способствует его проникновению преимущественно в гепатоциты [Блюгер А. Ф., 1989]. Иммунизация небольших коллективов такими вакцинами действительно препятствует их инфицированию, однако глобальная иммунизация создает совершенно определенное селективное давление на неоднородные популяции HBV, направленное на отбор подтипов вируса, содержащих структуры, узнающие рецепторы тканей о которых упомянуто выше.
А. Ф. Блюгером (1989) высказано предположение, что HBV может оказаться причиной различных системных инфекций. П. Тиолле и М. Буэндиа (1991) выявили один из возможных механизмов их формирования — включение HBV в различные участки клеток хромосом индуцирует генетические перестройки, такие как делеции, транслокации, амплификации. Подобные аномалии — общее явление для раковой патологии человека. В лаборатории авторов была обнаружена вставка ДНК HBV в ген, кодирующий рецепторы стероидных гормонов и гормонов щитовидной железы. Аналогичная интеграция HBV выявлена в гене, кодирующем циклин А. При ненормальной экспрессии этого гена нарушается регуляция пролиферации клеток.
Следовательно, широкомасштабная иммунизация против гепатита В при невозможности устранения первичных очагов инфекции, в отдаленной перспективе может способствовать изменению патогенеза данной болезни в крайне нежелательном для вида Homo sapiens направлении.
Новые клинические проявления болезни. В редких случаях и более часто с невирусными патогенами чем с вирусами, эволюционные изменения, приведшие к созданию нового варианта, могут обернуться и новыми клиническими проявлениями болезни. Эпидемия бразильской пурпурной лихорадки, произошедшая в 1990 г., связана с появившимся новым клональным вариантом Hemophilus influenzae биогруппы aegyptius. В эту же категорию возбудителей можно включить некоторые инвазивные штаммы Streptococcus группы А, вызывающие быстрые и сопровождающие некрозом фасций, инфекции [Morse S., 1995].
Разрушение общественного здравоохранения и недостаточное развитие его инфраструктуры. Традиционно общественное здравоохранение и санитария предназначались для минимизации распространения патогенов и экспозиции ими людей обычными путями, например, с водой, а также для их предотвращения с помощью иммунизации и контроля за носителями. Тем не менее, патогенные микроорганизмы часто сохраняются, хотя в значительно меньших количествах (хозяин-резервуар, окружающая среда). Следовательно, они могут вернуться вновь, если произойдут сбои в профилактических мероприятиях.
Повторно возникшие болезни, это те которые подобно холере уже «побеждались», но потом появлялись снова. Как правило, они хорошо изучены, и исходящая от них опасность общественному здравоохранению осознана. К сожалению, как в развивающихся странах, так в городах промышленного мира и в России, все чаще принятые меры оказываются недостаточными. Например, быстрому распространению холеры в Южной Америке способствовало уменьшения уровня хлорирования воды в системах водоснабжения; распространению дифтерии в России способствовало снижение популяционного иммунитета населения к возбудителю данной болезни. Следовательно, возвращение такого инфекционного заболевания чаще всего может быть сигналом поломки общественного здравоохранения. Оно должно рассматриваться как предупреждение против самодовольства в войне с инфекционными болезням [Morse S., 1995].
***
Большинство появившихся за последние годы в человеческом обществе инфекционных болезней, вызваны патогенами, уже существовавшими в окружающей среде. Они получили преимущества перед другими паразитическими видами в результате изменения природных условий и образования нового механизма проникновения в популяции своих новых хозяев. Сам процесс возникновения новой инфекционной болезни имеет два этапа:
агент интродуцируется в новую популяцию хозяина;
закрепляется в ней и распространяется дальше в популяции нового хозяина.
Факторы, обеспечивающие один или оба этих этапа, стимулируют возникновение новой инфекции. Среди них выделяют следующие:
1. Экологические изменения — обычно ускоряют появление инфекционной болезни путем создания контакта людей с естественным резервуаром или хозяином инфекции. Наиболее серьезным экологическим изменением предстоящего столетия является глобальное потепление. Оно неизбежно вызовет рост инфекций, возбудители которых распространяются переносчиками и водой, а также изменение границ регионов, в которых обычно наблюдаются эти инфекции.
2. Изменения в человеческой демографии и в поведении людей — позволяют инфекции, возникшей в отдаленных и изолированных сельских районах (которая могла бы остаться неизвестной и иметь ограниченное распространение), проникнуть в большие человеческие популяции городов и распространиться по всему миру. Очень большую опасность представляет и обратный процесс — инфицирование от людей диких животных, особенно приматов. Тем самым среди близкородственных видов формируются вторичные природные очаги инфекций, которые среди людей считаются уничтоженными или контролируемыми.
3. Международный туризм и коммерция — способствуют разносу возбудителей инфекционных болезней по всему миру. Однако, для того, чтобы болезнь смогла укорениться, в новом для неё регионе, должны иметься благоприятные для возбудителя болезни условия (наличие переносчиков и/или чувствительной популяции, определенные поведенческие стереотипы и др.).
4. Технологии и индустрия, применяемые для производства продуктов питания и других продуктов биологического происхождения, как правило, эффективны и недороги, но их использование одновременно увеличивает риск случайной контаминации и приводит к многократному усилению последствий такой случайности.
5. Микробные адаптация и изменения — способствуют образованию новых эпидемических вариантов возбудителей инфекционных болезней, либо изменяют патогенез вызываемой ими инфекционной болезни.
6. Разрушение общественного здравоохранения и недостаточное развитие его инфраструктуры способствуют проникновению в человеческое общество патогенных микроорганизмов, постоянно сохраняющихся в окружающей среде.