Ковалентная химическая связь | это... Что такое Ковалентная химическая связь? (original) (raw)
Ковалентная связь — связь, образованная направленными валентными электронными облаками. Нейтральные атомы размещены в узлах кристаллической решётки.
Содержание
- 1 Определение
- 2 Образование связи
- 3 Виды ковалентной связи
- 4 Примеры веществ с ковалентной связью
- 5 См. также
- 6 Литература
Определение
Ковалентной связью называется химическая связь, образующаяся за счёт обобществления атомами своих валентных электронов. Обязательным условием образования ковалентной связи является перекрывание атомных орбиталей (АО), на которых расположены валентные электроны. В простейшем случае перекрывание двух АО приводит к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО. Обобществленные электроны располагаются на более низкой по энергии связывающей МО:
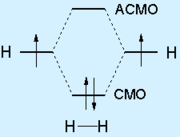
Образование связи
Ковалентная связь (атомная связь, гомеополярная связь) — связь между двумя атомами за счёт обобществления (electron sharing) двух электронов — по одному от каждого атома:
A. + В. -> А : В
По этой причине гомеополярная связь имеет направленный характер. Пара электронов, осуществляющая связь, принадлежит одновременно обоим связываемым атомам, например:
| .. | .. | .. | |||||||
|---|---|---|---|---|---|---|---|---|---|
| : | Cl | : | Cl | : | H | : | O | : | H |
| .. | .. | .. |
Виды ковалентной связи
Существуют три вида ковалентной химической связи, отличающихся механизмом ее образования:
1. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными. Если атомы, образующие простую ковалентную связь одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующиеся связь в равной степени владеют обобществленной электронной парой, такая связь называется неполярной ковалентной связью. Если атомы различны, тогда степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов, атом с большей электроотрицательностью в большей степени обладает парой электронов связи, и поэтому его истинный заряд имеет отрицательный знак, атом с меньшей электроотрицательностью приобретает соответственно такой же по величине заряд, но с положительным знаком.
2. Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов (донор), второй из атомов, участвующий в образовании связи называется акцептором. В образовавшейся молекуле формальный заряд атома донора увеличивается на единицу, а формальный заряд атома акцептора уменьшается на единицу.
3. Семиполярная связь. Этот вид ковалентной связи образуется между атомом, обладающим неподеленной парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа:
1. Окисление (перенос одного электрона) атома с НЭП атомом с двумя неспаренными электронами. В результате атом с НЭП превращается в катион-радикал (положительно заряженная частица с неспаренным электроном), а атом с двумя неспаренными электронами - в анион-радикал (отрицательно заряженная частица с неспаренным электроном).
2. Обобществление неспаренных электронов (как в случае простой ковалентной связи).
При образовании семиполярной связи атом с НЭП увеличивает свой формальный заряд на единицу, а атом с двумя неспаренными электронами понижает свой формальный заряд на единицу. Flash-клипы механизмов образования химических связей можно посмотреть здесь
Сигма (σ)-, пи (π )-связи — приближенное описание видов ковалентных связей в молекулах органических соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании π-связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен, ацетилен и бензол.
В молекуле этилена С2Н4 имеется двойная связь СН2=СН2, его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвертого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π-связью.
В линейной молекуле ацетилена
Н—С≡С—Н (Н : С ::: С : Н)
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две π-связи между этими же атомами углерода. Две π-связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
Все шесть атомов углерода циклической молекулы бензола С6H6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвертых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные π-связи, а единая π-электронная система из шести электронов, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола совершенно одинаковые.
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов. Различают две основные разновидности ковалентной связи:
- Ковалентная неполярная связь образуется между атомами неметалла одного и того же химического элемента. Такую связь имеют простые вещества, например О2; N2; C12.
- Ковалентная полярная связь образуется между атомами различных неметаллов.
В случае, например, с HCl, общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд , а на атоме водорода — частичный положительный .
Примеры веществ с ковалентной связью
Простой ковалентной связью соединены атомы в молекулах простых газов (Н2, Сl2 и др.) и соединений (Н2О, NH3, CH4, СО2, НСl и др.). Соединения с донорно-акцепторной связью - катион аммония NH4+, тетрафторборат aнион BF4- и др. Соединения с семиполярной связью - закись азота N2O, O--PCl3+.
Кристаллы с ковалентной связью диэлектрики или полупроводники. Типичными примерами атомных кристаллов (атомы в которых соединены между собой ковалентными (атомными) связями)могут служить алмаз, германий и кремний.
См. также
Литература
- «Химический энциклопедический словарь», М., «Советская энциклопедия», 1983, с.264.
| Органическая химия | ||||||||
|---|---|---|---|---|---|---|---|---|
| Ароматизация | Ковалентная связь | Функциональная группа | Номенклатура ИЮПАК | Органическое соединение | Органическая реакция | Органический синтез | Список публикаций по органической химии | Спектроскопия | Стереохимия |
| Список органических соединений |
| Структурная химия | ||||||
|---|---|---|---|---|---|---|
| Химическая связь: | Ароматичность | Ковалентная связь | Ионная связь | Металлическая связь | Водородная связь | Донорно-акцепторная связь | Таутомерия |
| Отображение структуры: | Функциональная группа | Структурная формула | Химическая формула | Лиганд | |||
| Электронные свойства: | Электроотрицательность | Сродство к электрону | Энергия ионизации | Диполь | Правило октета | ||
| Стереохимия: | Асимметрический атом | Изомерия | Конфигурация | Хиральность | Конформация |
Wikimedia Foundation.2010.