forbrenning – kjemi – Store norske leksikon (original) (raw)

Vedfyring er fortsatt vanlig i Norge.
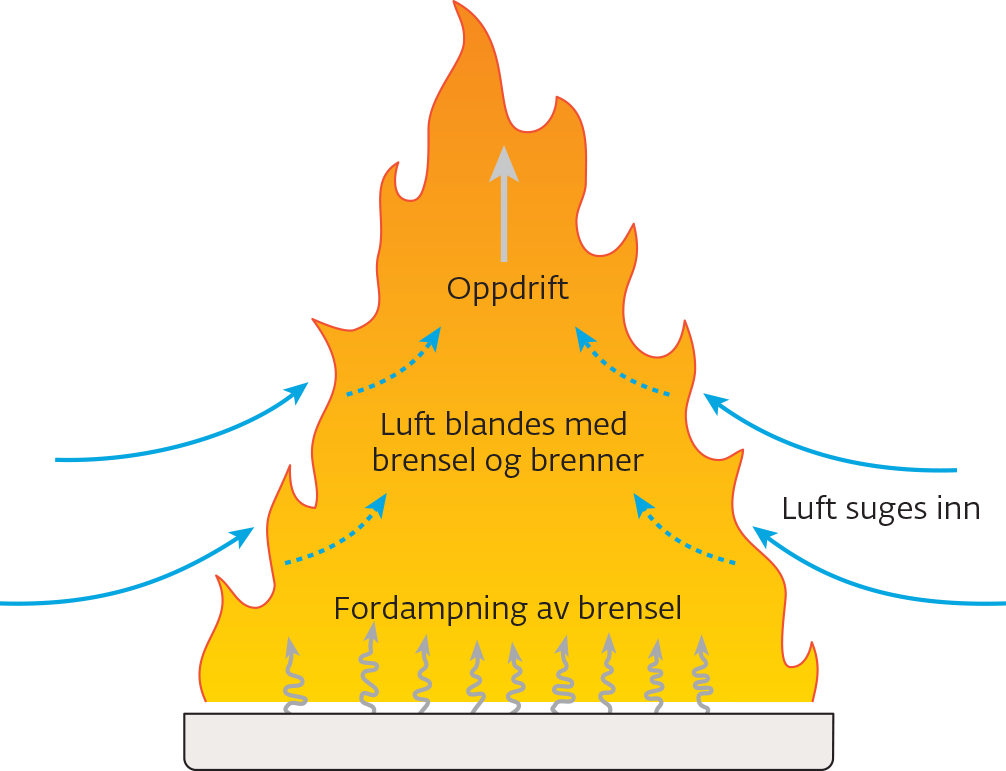
De fleste branner er diffusjonsforbrenninger. Det brennbare materialet varmes opp og avgir brennbare gasser, enten ved fordampning, dekomponering eller pyrolyse. Ved overflaten av materialet er det brennbar gass. Etter hvert som den brennbare gassen beveger seg fra overflaten, vil den bli innblandet med luft – og dermed få tilgang på oksygen. Når det mye tilgang på gass, blir flammene mer uregelmessige (turbulente) i bevegelsene. Da blandes det inn enda mer luft, og forbrenningen går raskere.
Forbrenning er en eksoterm kjemisk reaksjon mellom et stoff og oksygengass. Reaksjonen kan foregå så raskt at stoffet brenner med synlig flamme eller så langsomt at energien som frigjøres ledes bort så fort at ikke temperaturen stiger noe særlig.
Faktaboks
Også kjent som
combustion (eng.)
Det skilles mellom rask og langsom forbrenning. Rask forbrenning er for eksempel vedfyring. Langsom forbrenning er for eksempel cellenes nedbrytning av glukose. Se celleånding.
Rask forbrenning
Ved eller koks i en ovn reagerer med oksygengass i luften i en rask forbrenningsprosess. Forbrenningen skjer raskere og mer voldsomt i oksygengass enn i luft. En trepinne som gløder i luft, vil flamme opp i ren oksygengass.
Med overskudd av oksygengass er forbrenningsproduktene vann og karbondioksid. Ved underskudd av oksygengass kan det dannes sot, karbonmonoksid og polysykliske aromatiske hydrokarboner (PAH).
For å få et stoff til å brenne, må det få en temperatur som er over tenntemperaturen for stoffet. Noen eksempler er gitt i tabellen nedenfor.
Tenntemperaturen for et stoff avhenger av hvor finfordelt stoffet er. Forbrenningen av sagspon starter lettere enn et stykke tre, og sagmugg tennes så lett at det kan tenne ved romtemperatur. Temperaturen som forbrenning til slutt foregår ved, er vesentlig høyere enn tenntemperaturen.
Er tenntemperaturen til et stoff lavere enn vanlig romtemperatur, tennes stoffet spontant når det kommer i berøring med luft. Slike stoffer sier man er selvantennelige (pyrofore). Et eksempel er fosfin. Finpulverisert jern kan begynne å gløde i luft ved romtemperatur. Det gjelder også flere andre metaller.
Eksplosjon og detonasjon er forbrenningsprosesser som foregår særlig raskt. Se sprengstoff.
Langsom forbrenning
Langsomme eller stille forbrenninger er oksidasjonsprosesser som foregår ved lav temperatur uten synlig utvikling av lys og varme. Slike forbrenningsprosesser foregår i stor utstrekning i naturen.
Langsom forbrenning (celleånding) av glukose skjer i cellene. Her er også sluttproduktene vann og karbondioksid. Energien som frigjøres bidrar til å holde temperaturen i cellene oppe.
Forråtnelses- og gjæringsprosesser skyldes en langsom forbrenning. Av den grunn har kompost ofte en høyere temperatur enn omgivelsene. At jern ruster og andre metaller anløper i luft, kan også ses på som langsomme forbrenninger se også auto-oksidasjon.
Ved langsomme forbrenninger kan det oppstå selvantennelse når den utviklede energien ikke får anledning til å unnvike tilstrekkelig raskt. Det kan inntreffe i fuktig høy, kullbinger og når kluter som er gjennomfuktet av olje, blir liggende i en haug.
Tenntemperatur for noen stoffer
| Temperatur (°C) | |
|---|---|
| Hvitt fosfor | ca. 40 |
| Karbondisulfid | 101 |
| Eter | 180 |
| Bensin, dieselolje | 222–300 |
| Fyringsolje | 250 |
| Acetylen | 305 |
| Metanol | 400 |
| Etanol | 425 |
| Propan | 465 |
| Hydrogen | 470 |
| Metan | 535 |
| Aceton | 540 |
| Benzen | 595 |
| Karbonmonoksid | 650 |
Les mer i Store norske leksikon

Når veden varmes opp frigjøres gasser som så antennes, og karbonet i veden går igjen tilbake til gassform som karbondioksid (CO2). Ved fullstendig forbrenning av veden ser man at trær i stor grad er laget av luft - det som blir igjen i fast form er litt kull og aske.