Опсин | это... Что такое Опсин? (original) (raw)

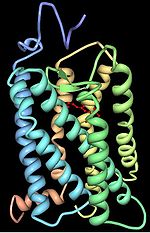
Трехмерная структура бычьего родопсина. Семь трансмембранных доменов показаны разными цветами. Хромофор — красный.
Опсины — это группа светочувствительных связанных с мембраной рецепторов, связанных с G-белками, массой около 35-55 кДа семейства ретинолидных белков, которые обнаружены в фоточувствительных клетках сетчатки. Пять групп опсинов принимают участие в зрении, передаче света в электрохимический сигнал, и являются первым этапом в каскаде зрительной трансдукции. Меланопсин — другой опсин, обнаруженный в сетчатке млекопитающих, который участвует в циркадианных ритмах и в зрачковом рефлексе, но не в формировании изображения.
Содержание
Классификация
Классифицируют два типа опсинов — первого и второго типов. Сходство в их структуре и функции указывает на их конвергентное происхождение у бактерий и животных.[1]
Опсины прокариот (первого типа)
Опсины прокариот имеют семь трансмембранных доменов, сходные по структуре с рецепторами, связанными с G-белками у эукариот. Но несмотря на такие сходства, нет никаких подтверждений того, что они имеют эволюционное сходство, по-видимому, эти белки эволюционировали независимо друг от друга.[1]
Некоторые бактерии фиксируют углерод без участия хлорофилла, используя для этого опсины первого типа (протеородопсины, халородопсины и бактериородопсины) Галобактерии используют чувствительные родопсины для фототаксиса, в этом процессе участвуют, связанные с плазматическими мембранами, белки системы передачи сигнала, не имеющие отношения к G-белкам.[2]
Группы опсинов второго типа
Два семейства опсинов позвоночных классифицируют по различиям в экспрессии и эволюционной истории. Родопсины, которые участвуют в ночном зрении, являются высокочувствительными, нерезкими опсинами и располагаются в палочках сетчатки. Опсины колбочек, которые участвуют в цветном зрении, являются низкочувствительными но резкими опсинами, и располагаются в клетках колбочек сетчатки. Опсины колбочек также классифицируют по длине волн максимального поглощения света. Также для классификации часто сравнивают аминокислотные последовательности опсинов разных групп. Оба подхода выделяют четыре основных группы опсинов.[3] У человека представлен следующий набор зрительных белков:
- Родопсин (Rh1, OPN2, RHO) — экспрессируется в палочках, участвует в ночном зрении
- Четыре типа опсинов колбочек (фотопсины) — экспрессируются в колбочках, участвуют в цветном зрении
- Чувствительные в области длинных волн (Long Wavelength Sensitive, LWS, OPN1LW) опсины — _λ_max в красном диапазоне
- Чувствительные в области волн средней длины (Middle Wavelength Sensitive, RH2 или MWS) опсины — _λ_max в зеленой части спектра
- Чувствительные в области коротких волн 2 (SWS2) опсины — _λ_max в синем диапазоне
- Чувствительные в области коротких волн 1 (SWS1) опсины — _λ_max в фиолетовой и ультрафиолетовой части диапазона
Для последних трех опсинов у человека известны гены OPN1MW, OPN1MW2, и OPN1SW.
Другие животные имеют разные наборы фоторецепторных белков, и их соответствующие спектры поглощения отличаются от человеческих белков. Поэтому восприятие света и изображений у человека и животных отличается. Некоторые насекомые, например, могут видеть в ультрафиолетовом диапазоне, а животные с одним типом опсинов видят окружающий мир черно-белым.
Структура и фукнции
Опсины ковалентно связаны с ретиналем — альдегидной формой витамина А, связывание идет через конденсацию альдегидной группы ретиналя с ε-аминогруппой остатка лизина в седьмой трансмембранной альфа-спирали с образованием основания Шиффа. У позвоночных хромофор находится в цис-форме. Поглощение фотона приводит к изменению конформации в транс-состояние. Фотоизомеризация вызывает конформационные изменения в белке опсине и активирует каскад фототрансдукции.
Опсины содержат семь трансмембранных альфа-спиральных доменов, соединенных тремя внеклеточными и тремя цитоплазматическими петлями. Многие остатки аминокислот являются эволюционно консервативными между разными группами опсинов.[4] Остаток Lys296 консервативен во всех известных опсинах и служит сайтом связывания основания Шиффа с хромофором.
См. также
Примечания
- ↑ 1 2 Fernald, Russell D. (2006), "«Casting a Genetic Light on the Evolution of Eyes»", Science Т. 313 (5795): 1914–1918, PMID 17008522, DOI 10.1126/science.1127889
- ↑ Römpler H, Stäubert C, Thor D, Schulz A, Hofreiter M, Schöneberg T (2007), "«G protein-coupled time travel: evolutionary aspects of GPCR research»", Molecular Interventions Т. 7 (1): 17-25, PMID 17339603, DOI 10.1124/mi.7.1.5
- ↑ Terakita A (2005). «The Opsins». Genome Biology 213 (6(3)): 213. DOI:10.1186/gb-2005-6-3-213.
- ↑ Palczewski K et al (2000). «Crystal Structure of Rhodopsin: A G Protein-Coupled Receptor». Science 289 (5480): 739–45. DOI:10.1126/science.289.5480.739. PMID 10926528.