Уравнение Клапейрона | это... Что такое Уравнение Клапейрона? (original) (raw)
Уравнение Клапейрона — Клаузиуса — термодинамическое уравнение, относящееся к квазистатическим (равновесным) процессам перехода вещества из одной фазы в другую (испарение, плавление, сублимация, полиморфное превращение и др.). Согласно уравнению, теплота фазового перехода (например, теплота испарения, теплота плавления) при квазистатическом процессе определяется выражением

где  — удельная теплота фазового перехода,
— удельная теплота фазового перехода,  — изменение удельного объёма тела при фазовом переходе.
— изменение удельного объёма тела при фазовом переходе.
Уравнение названо в честь его авторов, Рудольфа Клаузиуса и Бенуа Клапейрона.
Элементарный вывод

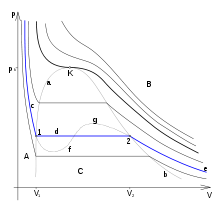
Между температурой фазового перехода и внешним давлением существует функциональная связь, причём при фазовом переходе производная  терпит разрыв. Тогда изотермы для рассматриваемого вещества будут иметь характерный вид, изображённый на рисунке. Для вывода существенен горизонтальный участок изотермы, соответствующий фазовому переходу. Слева и справа от этого участка всё вещество находится в одной фазе. Осуществим цикл Карно при бесконечно малой разности температур следующим образом: сначала сообщаем телу теплоту, переводя его из состояния 1 в состояние 2, затем адиабатически охлаждаем его на температуру dT, после чего замыкаем цикл, отводя теплоту и переводя вещество в фазу 1 с последующим адиабатическим нагревом. Совершённая работа равна площади цикла:
терпит разрыв. Тогда изотермы для рассматриваемого вещества будут иметь характерный вид, изображённый на рисунке. Для вывода существенен горизонтальный участок изотермы, соответствующий фазовому переходу. Слева и справа от этого участка всё вещество находится в одной фазе. Осуществим цикл Карно при бесконечно малой разности температур следующим образом: сначала сообщаем телу теплоту, переводя его из состояния 1 в состояние 2, затем адиабатически охлаждаем его на температуру dT, после чего замыкаем цикл, отводя теплоту и переводя вещество в фазу 1 с последующим адиабатическим нагревом. Совершённая работа равна площади цикла:

Сообщённая теплота равна

где  — удельная теплота фазового перехода,
— удельная теплота фазового перехода,  — масса тела. Согласно теореме Карно,
— масса тела. Согласно теореме Карно,

Отсюда

Литература
- Сивухин Д. В. Общий курс физики. — Издание 3-е, исправленное и дополненное. — М.: Наука, 1990. — Т. II. Термодинамика и молекулярная физика. — 592 с. — ISBN 5-02-014187-9