Алюмогидрид лития | это... Что такое Алюмогидрид лития? (original) (raw)
| Алюмогидрид лития | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование | тетрагидридоалюминат лития |
| Сокращения | LAH |
| Традиционные названия | Тетрагидридоалюминат лития, алюмогидрид лития, литийалюминий гидрид, аланат лития |
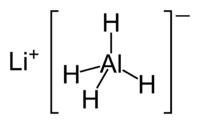
| Химическая формула | LiAlH4 |
| Физические свойства | |
| Состояние (ст. усл.) | белые кристаллы |
| Отн. молек. масса | 37,95 а. е. м. |
| Молярная масса | 37,95 г/моль |
| Плотность | 0,917 г/см³ |
| Термические свойства | |
| Температура разложения | 150 °C |
| Энтальпия образования (ст. усл.) | -107 кДж/моль |
| Химические свойства | |
| Растворимость в диэтиловом эфире | 25 г/100 мл |
| Растворимость в ТГФ | 15 г/100 мл |
| Структура | |
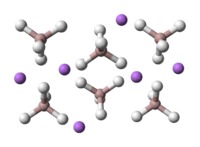
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS | 16853-85-3 |
| Рег. номер PubChem | 28112 |
| SMILES | [Li+].[AlH4-] |
| Регистрационный номер EC | 240-877-9 |
| RTECS | BD0100000 |
Алюмогидрид лития (аланат лития) — неорганическое соединение, комплексный смешанный гидрид лития и алюминия с формулой Li[AlH4], белые кристаллы. Сильный восстановитель, используемый в органическом синтезе. Мощнее других часто используемых агентов, например борогидрида натрия, благодаря более слабым связям Al-H по сравнению с B-Н. Восстанавливает сложные эфиры, карбоновые кислоты и кетоны до спиртов, нитросоединения до аминов.
Получение
- Действием хлорида алюминия на суспензию гидрида лития в эфире:
![\mathsf{4LiH + AlCl_3 \ \xrightarrow{\ \ }\ Li[AlH_4] + 3LiCl }](https://dic.academic.ru/dic.nsf/ruwiki/8b5c42f1d91eee251c962823340e2319.png)
Физические свойства
Тетрагидридоалюминат лития образует бесцветные кристаллы, растворим в эфире, тетрагидрофуране.
Технический продукт (ЛАГ) — твердые серые куски, очень легок. После измельчения — растворим в эфире. Бурно реагирует с водой, содержащейся во влажном воздухе и способен к самовозгоранию. Промышленный продукт выпускается с добавлением минеральных масел для защиты от воздуха.
Очищенный перекристаллизацией имеет вид белых кристаллов. Промышленный обычно серого цвета из-за следов металлического алюминия. При хранении во влажном воздухе разлагается на гидроксиды лития и алюминия.
Химические свойства
- Термически неустойчив:
![\mathsf{2Li[AlH_4] \ \xrightarrow{>125^oC}\ 2LiH + 2Al + 3H_2\uparrow }](https://dic.academic.ru/dic.nsf/ruwiki/c8ddfe722851c2aa3f20ca30aae4be76.png)
- Гидролизуется водой:
![\mathsf{Li[AlH_4] + 4H_2O \ \xrightarrow{\ }\ LiOH + Al(OH)_3 + 4H_2\uparrow }](https://dic.academic.ru/dic.nsf/ruwiki/fc87b39d73d4a465cea0ae037d817a06.png)
- Реагирует с разбавленными кислотами на холоде:
![\mathsf{Li[AlH_4] + HCl + 3H_2O \ \xrightarrow{\ }\ LiCl + Al(OH)_3 + 4H_2\uparrow }](https://dic.academic.ru/dic.nsf/ruwiki/c529bd8eaca7558e4d858cee95ab421f.png)
- Окисляется кислородом:
![\mathsf{2Li[AlH_4] + 4O_2 \ \xrightarrow{250^oC}\ Li_2O + Al_2O_3 + 4H_2O }](https://dic.academic.ru/dic.nsf/ruwiki/28ceaec4cba8f1923209ce558b15a20e.png)
Применение
- В органическом синтезе.
- Для получения неводных электролитов, из которых гальваническим способом осаждается алюминиевое покрытие.
Ссылки
- Применение LiAlH4 в органическом синтезе
- Condensed phase thermochemistry data from Nist webbook
- Materials Safety Data Sheet from Cornell University
- Sandia National Laboratory — Hydride information center
- Synthesis of LAH
- Reduction reactions, University of Birmingham, Teaching Resources — 4th Year
- PubChem LiAlH4 summary
Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
