Элемент Лекланше | это... Что такое Элемент Лекланше? (original) (raw)
Элемент Лекланше, названный по имени его изобретателя Ж. Лекланше (1865 г.), является самым известным первичным элементом (батарея одноразового использования), который сегодня широко используется в радио, часах, фонариках и т. д. Также элемент Лекланше называют «сухим элементом».
Сухой элемент
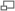
Процессы, происходящие в сухом элементе
В качестве электродов в сухом элементе выступают цинковый стакан и угольный стержень. Поэтому сухой элемент называют еще угольно-цинковым элементом. Цинк выступает в роли анода, уголь- в роли катода. Угольный стержень окружен смесью диоксида марганца (MnO2) и угля (сажи). В качестве электролита выступает раствор хлорида аммония (NH4Cl) с небольшой добавкой хлорида цинка (ZnCl2) сгущенный крахмалом и мукой. Сухой элемент герметичен, воздухонепроницаем. При потреблении тока электроны поступают (через внешнюю электрическую цепь) с цинкового анода на угольный стержень. Происходят следующие реакции:
Анод: Zn → Zn 2+ + 2e-
На угольном стержне, катоде, электроны расходуются на восстановление H3O+-ионов:
2H3O+ + 2e- → H2 + 2H2O
Ионы H3O+ образуются в результате частичного протолиза NH4+-ионов электролита:
NH4+ + H2O ↔ H3O+ + NH3
При восстановлении H3O+-ионов образуется водород, который не может удалиться (корпус герметичен) и образует вокруг угольного стержня прослойку газа (поляризация угольного электрода). Ток медленно затухает. Чтобы избежать образования водорода, угольный электрод окружают слоем диоксида марганца (MnO2) . В присутствии диоксида марганца H3O+-ионы восстанавливаются с образованием воды:
2MnO2 + 2H3O+ + 2e- → 2MnO(OH) + 2H2O
Таким способом избегают поляризации электрода, а диоксид марганца называют деполяризатором. Электролит NH4Cl диссоциирует и частично протолизируется. В общем:
2NH4Cl + 2H2O ↔ 2NH3 + 2H3O+ + 2Cl-
Образующиеся на аноде ионы Zn2+ поступают в раствор и образуют труднорастворимую соль, цинкдиамминхлорид:
Zn2+ + 2NH3 + 2Cl- → [Zn(NH3)2]Cl2
В общем:
Анод: Zn — 2e- → Zn2+
Катод: 2MnO2 + 2H3O+ + 2e- → 2MnO(OH) + 2H2O
Раствор электролита: Zn2+ + 2NH4+ + 2Cl- + 2H2O ↔ [Zn(NH3)2]Cl2 + 2H3O+
Общая реакция: Zn + 2MnO2 + 2NH4Cl → 2MnO(OH) + [Zn(NH3)2]Cl2
Во время разрядки цинковый стакан частично растворяется. Во избежание вытекания электролита или продуктов реакции цинковый стакан имеет запас по толщине или окружён железной защитной оболочкой.

