NMDA-антагонист | это... Что такое NMDA-антагонист? (original) (raw)

Кетамин, распространённый NMDA-антагонист
Антагонисты NMDA рецептора, или NMDA-антагонисты (иногда «НМДА-антагонисты») — класс анестетиков, ингибирующих действие N-метил-D-аспартатного (NMDA) рецептора. NMDA-антагонисты часто применяются для анестезии животных, реже — человека, у которого они вызывают состояние так называемой диссоциативной анестезии. Исследования на грызунах показывают, что NMDA-антагонисты при чрезмерном использовании могут вызывать специфическое повреждение мозга — так называемые «лезии Олни», однако пока нет опубликованных данных о выраженности этой патологии у приматов.
Некоторые NMDA-антагонисты, такие как кетамин, декстрометорфан и фенциклидин, обрели популярность у любителей психоактивных веществ благодаря своим галлюциногенным свойствам. При использовании в целях получения удовольствия и новых ощущений они классифицируются как диссоциативные средства. При низкой субанестетической дозировке они оказывают слабое стимулирующее действие, за которым при повышении дозировки следует диссоциация и галлюцинации.[1]
Содержание
- 1 Применение и действие
- 2 Нейротоксичность
- 3 Возможное противодействие эксайтотоксичности
- 4 Механизм действия
- 5 Примеры NMDA-антагонистов
- 6 Смотри также
- 7 Примечания
Применение и действие
Диссоциативная анестезия, вызываемая NMDA-антагонистами, характеризуется каталепсией, амнезией и анальгезией.[2] Кетамин и другие NMDA-антагонисты наиболее часто сочетаются с диазепамом при анестезии в ходе операций косметической и восстановительной пластической хирургии,[3] а также при оперировании ожогов.[4] Кетамин является препаратом выбора при неотложных операциях, когда анамнез пациента неясен, потому что он в меньшей степени подавляет дыхательную активность и кровообращение по сравнению с другими анестетиками.[5] Декстрометорфан широко используется в качестве противокашлевого средства.[6]
Подавление функции NMDA-рецептора вызывает ряд негативных симптомов. Так, угасание его активности с возрастом может отчасти обусловливать ухудшение памяти в старости.[7] Шизофрению также связывают с неустойчивой активацией NMDA-рецептора, в рамках «глутаматной гипотезы»,[8] направленной на объяснение некоторых клинических находок и патологических проявлений болезни.[9] Догадки о возможной связи шизофрении с NMDA-гипофункцией появились при изучении наркоманов, потреблявших в начале 1980х NMDA-антагонист — «ангельскую пыль»,[10] хотя, возможно, её психотомиметический эффект не ограничивается действием на NMDA-рецептор.[11] Эндогенным NMDA-антагонистом является также кинуреновая кислота, повышение уровней которой гипотетически связывают с ухудшением симптомов шизофрении.[12] Антагонисты NMDA-рецептора вызывают нарушения, схожие с вышеуказанными, а при их избыточном или длительном приёме возникают «психотомиметические» эффекты, напоминающие психозы при шизофрении.[13] В частности, при использовании этих препаратов отмечались галлюцинации, параноидный бред, замешательство, рассредоточенность, возбуждение, перепады настроения, кошмары,[14] кататония,[15] атаксия,[16] анестезия,[17] снижение способностей к обучению и нарушение памяти.[18] У животных длительный приём NMDA-антагонистов снижает экспрессию парвальбумина и ГАМК-синтезирующего фермента GAD67, что совпадает с изменениями, обнаруживаемыми посмертно в мозге людей, больных шизофренией.[19]
NMDA-антагонисты метаболизируются печенью,[20][21] и частое их использование может вызвать толерантность, поскольку со временем печень ускорит вывод активных веществ из кровотока.[22]
Нейротоксичность
NMDA-антагонисты могут вызвать серьёзное повреждение мозга в таких областях, как кора поясной извилины и ретроспленальная кора. Экспериментальный NMDA-антагонист MK-801 в опытах вызывает у грызунов нейрональную вакуолизацию, развивающуюся в необратимые повреждения, «лезии Олни»[23][24]. Обнаружено множество средств, способных снизить риск нейротоксичности при использовании NMDA-антагонистов. Альфа-2 агонисты центрального действия, такие как клонидин и гуанфацин, как считается, обладают наиболее специфическим влиянием на этиологию токсического процесса. Нейротоксичность антагонистов могут снижать и другие медикаменты, действующие на различные нейромедиаторные системы — это антихолинергические препараты, диазепам, барбитураты[25], этанол[26], агонисты серотониновых 5-HT2A рецепторов[27] и мусцимол[28].
Возможное противодействие эксайтотоксичности
Токсичность при перевозбуждении нейронов, или эксайтотоксичность, во многом связана с активностью NMDA-рецепторов, и поэтому исследователи возлагали надежды на применение антагонистов в противодействии эксайтотоксичности при травмах мозга, инсульте, нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона. Противовесом служит риск развития лезий Олни,[29] хотя есть свидетельства того, что они не возникают у людей, к тому же успешно начат поиск средств для предотвращения данного осложнения.[28][26] Неблагоприятные побочные эффекты стали причиной провала большинства клинических испытаний NMDA-антагонистов, поскольку рецепторы играют важную роль в работе глутаматергической системы.[30] Вмешательством в нормальную работу мозга можно объяснить и гибель нейронов, иногда отмечающуюся при использовании антагонистов.[31]
Механизм действия
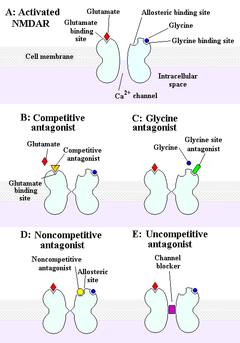
NMDAR — ионотропный рецептор, пропускающий электрические сигналы от нейрона к нейрону в головном и спинном мозге. Для передачи сигнала канал рецептора должен быть открыт. Чтобы открыть канал, требуются лиганды: глутамат и глицин. При открытии канала и одновременной связи с глицином и глутаматом, NMDA-рецептор называют «активированным».
Антагонисты, связываясь с аллостерическими сайтами на белках, составляющих рецептор, закрывают ионный канал, ингибируя его активность. Всего выделяют четыре категории антагонистов:
конкурентные
блокирующие место связи рецептора с глутаматом,
глициновые антагонисты
блокирующие глициновый сайт,
неконкурентные — связывающиеся с аллостерическими сайтами,
неконкурентные, блокирующие сам ионный канал.
Примеры NMDA-антагонистов
Неконкурентные прямого действия (блокаторы ионного канала):
- Амантадин — терапия болезни Паркинсона и гриппа.[32][33]
- Декстрометорфан — распространенное противокашлевое составляющее многих лекарств.[34]
- Декстрорфан — активный метаболит декстрометорфана. Запрещён к свободной продаже.[34][35]
- Ибогаин — запрещенная субстанция.[35][36]
- Кетамин — анестетик, психоактивное средство.[37]
- Закись азота — анестезия, в частности, при лечении зубов.[38]
- Фенциклидин, запрещён.[35]
- Рилузол — терапия амиотрофического латерального склероза.[39]
- Тилетамин — анестезия животных.
- Мемантин — антагонист с умеренной аффинностью, зависимый от напряжения.[40] Терапия болезни Альцгеймера.[41]
Неконкурентные антагонисты аллостерического действия:
- Дизоцильпин (MK-801) — экспериментальный препарат.[42]
- Аптиганел — связывается с Mg2+ сайтом.
- Ремацимид — его основной метаболит представляет собой низкоаффинный антагонист.[43]
- HU-211, энантиомер сильнодействующего каннабиоида HU-210, не имеющий психоактивных свойств каннабиоидов.[44]
Глициновые антагонисты:
- 7-хлорокинуренат.[45]
- DCKA (5,7-дихлорокинуреновая кислота).[46]
- Кинуреновая кислота — вырабатывается в организме человека.[47]
- 1-аминоциклопропанокарбоксильная кислота (ACPC)
- Лакозамид, протопип с возможной антиэпилептической активностью, а также возможное средство против нейропатической боли при диабете.[48]
Конкурентные антагонисты:
- AP7 (2-амино-7-фосфоногептаноевая кислота)[49]
- APV (R-2-амино-5-фосфонопентаноат)[50]
- CPPene (3-[(R)-2-карбоксипиперазин-4-yl]-проп-2-энил-1-фосфоновая кислота)[51]
Смотри также
Примечания
- ↑ Lim D (2003). «Ketamine associated psychedelic effects and dependence». Singapore Med J 44 (1): 31–4. PMID 12762561.
- ↑ Pender J (1971). «Dissociative anesthesia». JAMA 215 (7): 1126–30. DOI:10.1001/jama.215.7.1126. PMID 5107596.
- ↑ Ersek R (2004). «Dissociative anesthesia for safety's sake: ketamine and diazepam--a 35-year personal experience». Plast Reconstr Surg 113 (7): 1955–9. PMID 15253183.
- ↑ Ceber M, Salihoglu T. «Ketamine may be the first choice for anesthesia in burn patients». J Burn Care Res 27 (5): 760–2. PMID 16998413.
- ↑ Heshmati F, Zeinali M, Noroozinia H, Abbacivash R, Mahoori A (2003). «Use of ketamine in severe status asthmaticus in intensive care unit». Iran J Allergy Asthma Immunol 2 (4): 175–80. PMID 17301376.
- ↑ Equinozzi R, Robuschi M (2006). «Comparative Efficacy and Tolerability of Pholcodine and Dextromethorphan in the Management of Patients with Acute, Non-Productive Cough : A Randomized, Double-Blind, Multicenter Study». Treat Respir Med 5 (6): 509–513. DOI:10.2165/00151829-200605060-00014. PMID 17154678.
- ↑ Newcomer, JW; Krystal JH (2001). «NMDA receptor regulation of memory and behavior in humans». Hippocampus 11 (5): 529–542. PMID 11732706. Проверено 2007-01-17.
- ↑ Bita Moghaddam Glutamate Hypothesis of Schizophrenia. Schizophrenia Research Forum (2005). Архивировано из первоисточника 28 июня 2012.. Перевод: Бита Могхаддам Глутаматная гипотеза шизофрении.(недоступная ссылка — история)
- ↑ Lipina, T; Labrie V, Weiner I, Roder J (2005). «Modulators of the glycine site on NMDA receptors, D-serine and ALX 5407, display similar beneficial effects to clozapine in mouse models of schizophrenia». Psychopharmacology 179 (1): 54–67. PMID 15759151. Проверено 2007-01-17.
- ↑ Interview with Dr. Javitt on Glycine and Schizophrenia Research . schizophrenia.com (май 2005 г.). Архивировано из первоисточника 28 июня 2012. Перевод: Интервью с Дэном Джавитом (Javitt) относительно глицина и исследований шизофрении. Архивировано из первоисточника 28 июня 2012.
- ↑ Evaluation of NMDA receptor models of schizophrenia: divergences in the behavioral effects of sub-chronic PCP and MK-801. Seillier A, Giuffrida A. Behav Brain Res. 2009 Dec 7;204(2):410-5. Epub 2009 Feb 14. PMID 19716985
- ↑ Erhardt S, Schwieler L, Nilsson L, Linderholm K, Engberg G (September 2007). «The kynurenic acid hypothesis of schizophrenia». Physiol. Behav. 92 (1-2): 203–9. DOI:10.1016/j.physbeh.2007.05.025. PMID 17573079.
- ↑ Pomarol-Clotet E, Honey GD, Murray GK, Corlett PR, Absalom AR, Lee M, McKenna PJ, Bullmore ET, Fletcher PC (August 2006). «Psychological effects of ketamine in healthy volunteers. Phenomenological study». Br J Psychiatry 189: 173–9. DOI:10.1192/bjp.bp.105.015263. PMID 16880489.
- ↑ Muir, KW; Lees KR (1995). «Clinical experience with excitatory amino acid antagonist drugs». Stroke 26 (3): 503–513. Проверено 2007-01-17.
- ↑ Aarts, MM; Tymianski M (2003). «Novel treatment of excitotoxicity: targeted disruption of intracellular signalling from glutamate receptors». Biochemical Pharmacology 66 (6): 877–886. PMID 12963474. Проверено 2007-01-17.
- ↑ 1 2 Kim AH, Kerchner GA, and Choi DW. (2002). «Blocking Excitotoxicity». In CNS Neuroproteciton. Marcoux FW and Choi DW, editors. Springer, New York. Pages 3-36.
- ↑ Kristensen, JD; Svensson B, and Gordh T Jr (1992). «The NMDA-receptor antagonist CPP abolishes neurogenic 'wind-up pain' after intrathecal administration in humans». Pain 51 (2): 249–253. PMID 1484720. Проверено 2007-01-17.
- ↑ Rockstroh, S; Emre M, Tarral A, and Pokorny R (1996). «Effects of the novel NMDA-receptor antagonist SDZ EAA 494 on memory and attention in humans». Psychopharmacology 124 (3): 261–266. PMID 8740048. Проверено 2007-01-17.
- ↑ Behrens MM, Ali SS, Dao DN, Lucero J, Shekhtman G, Quick KL, Dugan LL (December 2007). «Ketamine-induced loss of phenotype of fast-spiking interneurons is mediated by NADPH-oxidase». [[Science (journal)|Science]] 318 (5856): 1645–7. DOI:10.1126/science.1148045. PMID 18063801.
- ↑ Chia YY, Liu K, Chow LH, Lee TY (1999). «The preoperative administration of intravenous dextromethorphan reduces postoperative morphine consumption». Anesth. Analg. 89 (3): 748–52. PMID 10475318.
- ↑ Kharasch ED, Labroo R (1992). «Metabolism of ketamine stereoisomers by human liver microsomes». Anesthesiology 77 (6): 1201–7. PMID 1466470.
- ↑ Livingston A, Waterman AE (1978). «The development of tolerance to ketamine in rats and the significance of hepatic metabolism». Br. J. Pharmacol. 64 (1): 63–9. PMID 698482.
- ↑ Olney J, Labruyere J, Price M (1989). «Pathological changes induced in cerebrocortical neurons by phencyclidine and related drugs». Science 244 (4910): 1360–2. DOI:10.1126/science.2660263. PMID 2660263.
- ↑ Hargreaves R, Hill R, Iversen L. «Neuroprotective NMDA antagonists: the controversy over their potential for adverse effects on cortical neuronal morphology». Acta Neurochir Suppl (Wien) 60: 15–9. PMID 7976530.
- ↑ Olney J, Labruyere J, Wang G, Wozniak D, Price M, Sesma M (1991). «NMDA antagonist neurotoxicity: mechanism and prevention». Science 254 (5037): 1515–8. DOI:10.1126/science.1835799. PMID 1835799.
- ↑ 1 2 Farber, NB (2004). «In the adult CNS, ethanol prevents rather than produces NMDA antagonist-induced neurotoxicity.». PMID 15518643. Проверено 2007-01-18.
- ↑ Farber N, Hanslick J, Kirby C, McWilliams L, Olney J (1998). «Serotonergic agents that activate 5HT2A receptors prevent NMDA antagonist neurotoxicity». Neuropsychopharmacology 18 (1): 57–62. DOI:10.1016/S0893-133X(97)00127-9. PMID 9408919.
- ↑ 1 2 Farber, NB (2003). «Muscimol prevents NMDA antagonist neurotoxicity by activating GABAA receptors in several brain regions.». PMID 14642834. Проверено 2007-01-18.
- ↑ Maas, AI (2001). «Neuroprotective agents in traumatic brain injury». Expert Opinion On Investigational Drugs 10 (4): 753–767. PMID 11281824. Проверено 2007-01-17.
- ↑ Chen, HS; Lipton SA. «The chemical biology of clinically tolerated NMDA receptor antagonists». Journal of Neurochemistry 97 (6): 1611–1126. PMID 16805772. Проверено 2007-01-17.
- ↑ Gardoni, F; Di Luca M (2006). «New targets for pharmacological intervention in the glutamatergic synapse». European Journal of Pharmacology 545 (1): 2–10. PMID 16831414. Проверено 2007-01-17.
- ↑ Effects of N-Methyl-D-Aspartate (NMDA)-Receptor Antagonism on Hyperalgesia, Opioid Use, and Pain After Radical Prostatectomy (англ.). University Health Network, Toronto (September 2005). Архивировано из первоисточника 28 июня 2012.
- ↑ Amantadine. Drug Information. MedlinePlus. Архивировано из первоисточника 28 июня 2012. Accessed May 29, 2007
- ↑ 1 2 Wong BY, Coulter DA, Choi DW, Prince DA (1988). «Dextrorphan and dextromethorphan, common antitussives, are antiepileptic and antagonize N-methyl-D-aspartate in brain slices». Neurosci. Lett. 85 (2): 261–6. PMID 2897648.
- ↑ 1 2 3 Controlled Substances Act (англ.). the US Drug Enforcement Administration (DEA) (May 29, 2007).(недоступная ссылка — история)
- ↑ Popik P, Layer RT, Skolnick P (1994): «The putative anti-addictive drug ibogaine is a competitive inhibitor of [3H]MK-801 binding to the NMDA receptor complex.» Psychopharmacology (Berl), 114(4), 672-4. Abstract.
- ↑ Harrison N, Simmonds M (1985). «Quantitative studies on some antagonists of N-methyl D-aspartate in slices of rat cerebral cortex». Br J Pharmacol 84 (2): 381–91. PMID 2858237.
- ↑ Grasshoff C, Drexler B, Rudolph U, Antkowiak B (2006). «Anaesthetic drugs: linking molecular actions to clinical effects». Curr. Pharm. Des. 12 (28): 3665–79. PMID 17073666.
- ↑ Hugon J (1996). «ALS therapy: targets for the future». Neurology 47 (6 Suppl 4): S251–4. PMID 8959997.
- ↑ Robinson, DM; Keating GM (2006). «Memantine: a review of its use in Alzheimer's disease». Drugs 66 (11): 1515–1534. PMID 16906789. Проверено 2007-01-17.
- ↑ Chawla, PS; Kochar MS (2006). «What's new in clinical pharmacology and therapeutics». WMJ 105 (3): 24–29. PMID 16749321. Проверено 2007-01-17.
- ↑ Fix AS, Horn JW, Wightman KA, et al (1993). «Neuronal vacuolization and necrosis induced by the noncompetitive N-methyl-D-aspartate (NMDA) antagonist MK(+)801 (dizocilpine maleate): a light and electron microscopic evaluation of the rat retrosplenial cortex». Exp. Neurol. 123 (2): 204–15. DOI:10.1006/exnr.1993.1153. PMID 8405286.
- ↑ Muir, KW (2005). «Glutamate-based therapeutic approaches: clinical trials with NMDA antagonists». Current Opinion in Pharmacology 6 (1): 53–60. PMID 16359918. Проверено 2007-01-17.
- ↑ Nadler V, Mechoulam R, Sokolovsky M. The non-psychotropic cannabinoid (+)-(3S,4S)-7-hydroxy-delta 6- tetrahydrocannabinol 1,1-dimethylheptyl (HU-211) attenuates N-methyl-D-aspartate receptor-mediated neurotoxicity in primary cultures of rat forebrain. Neuroscience Letters. 1993 Nov 12;162(1-2):43-5. PMID 8121633
- ↑ Hartley DM, Monyer H, Colamarino SA, Choi DW (1990). «7-Chlorokynurenate Blocks NMDA Receptor-Mediated Neurotoxicity in Murine Cortical Culture». Eur J Neurosci 2 (4): 291–295. DOI:10.1111/j.1460-9568.1990.tb00420.x. PMID 12106035.
- ↑ Frankiewicz T, Pilc A, Parsons C (2000). «Differential effects of NMDA-receptor antagonists on long-term potentiation and hypoxic/hypoglycaemic excitotoxicity in hippocampal slices». Neuropharmacology 39 (4): 631–42. DOI:10.1016/S0028-3908(99)00168-9. PMID 10728884.
- ↑ Khan MJ, Seidman MD, Quirk WS, Shivapuja BG (2000). «Effects of kynurenic acid as a glutamate receptor antagonist in the guinea pig». European archives of oto-rhino-laryngology : official journal of the European Federation of Oto-Rhino-Laryngological Societies (EUFOS) : affiliated with the German Society for Oto-Rhino-Laryngology - Head and Neck Surgery 257 (4): 177–81. PMID 10867830.
- ↑ Prous Science: Molecule of the Month (January 2005). Архивировано из первоисточника 28 июня 2012.
- ↑ van den Bos R, Charria Ortiz G, Cools A (1992). «Injections of the NMDA-antagonist D-2-amino-7-phosphonoheptanoic acid (AP-7) into the nucleus accumbens of rats enhance switching between cue-directed behaviours in a swimming test procedure». Behav Brain Res 48 (2): 165–70. DOI:10.1016/S0166-4328(05)80153-6. PMID 1535501.
- ↑ Abizaid A, Liu Z, Andrews Z, Shanabrough M, Borok E, Elsworth J, Roth R, Sleeman M, Picciotto M, Tschöp M, Gao X, Horvath T (2006). «Ghrelin modulates the activity and synaptic input organization of midbrain dopamine neurons while promoting appetite». J Clin Invest 116 (12): 3229–39. DOI:10.1172/JCI29867. PMID 17060947.
- ↑ Eblen F, Löschmann P, Wüllner U, Turski L, Klockgether T (1996). «Effects of 7-nitroindazole, NG-nitro-L-arginine, and D-CPPene on harmaline-induced postural tremor, N-methyl-D-aspartate-induced seizures, and lisuride-induced rotations in rats with nigral 6-hydroxydopamine lesions». Eur J Pharmacol 299 (1-3): 9–16. DOI:10.1016/0014-2999(95)00795-4. PMID 8901001.