Сульфурилфторид | это... Что такое Сульфурилфторид? (original) (raw)
| Сульфурилфторид | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование | Сульфурилфторид, Серный фторид |
| Химическая формула | SO2F2 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветный газ |
| Молярная масса | 102,06 г/моль |
| Плотность | при 0 °C 1,623 г/см³ |
| Термические свойства | |
| Температура плавления | −135,7 °C |
| Температура кипения | −55,2 °C |
| Температура разложения | 400 °C |
| Химические свойства | |
| Растворимость в воде | 4,5 мл/100 мл, ?? |
| Растворимость в H2SO4 | 0 г/100 мл |
| Классификация | |
| Рег. номер CAS | 2699-79-8 |
| Безопасность | |
| Токсичность | высокая |
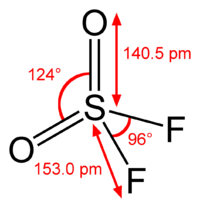
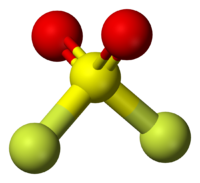
Сульфурилфторид — бесцветный газ (при нормальных условиях) без запаха. Молекула сульфурилфторида имеет конфигурацию искажённого тетраэдра, с расположенным в центре шестивалентным атомом серы.
Реакционная способность
Сульфурилфторид является дифторангидридом серной кислоты, однако он значительно менее реакционноспособен по отношению к нуклеофилам, чем хлористый сульфурил, напоминая своей инертностью гексафторид серы.
Сульфурилфторид растворим в воде (4,5 мл на 100 мл при 16,5 °C), однако его гидролиз в нейтральных и кислых растворах протекает медленно и он может быть отогнан из таких растворов при пониженном давлении.
Сульфурилфторид является электрофилом и быстро гидролизуется в щелочных растворах до фторсульфоната:
SO2F2 + 2 OH−  FSO3− + F− + OH−,
FSO3− + F− + OH−,
реакция протекает по механизму нуклеофильного замещения. В водных растворах цианидов сульфурилфторид быстро гидролизуется до сульфата.
Сульфурилфторид также быстро реагирует с водными растворами нуклеофилов: так, с аммиаком он образует сульфуриламид:
SO2F2 + 4 NH3  SO2(NH2)2 + 2 NH4F
SO2(NH2)2 + 2 NH4F
и с фенолятом натрия:
SO2F2 + PhONa  PhOSO2F + NaF
PhOSO2F + NaF
Синтез
Впервые сульфурилфторид был получен Муассаном и Лебо фторированием диоксида серы, в качестве катализатора использовалась нагретая платина, так как при смешение газообразных фтора с диоксидом серы при комнатной температуре зачастую приводило к взрывам:
SO2 + F2  SO2F2
SO2F2
В лабораторной практике синтеза сульфурилхлорида обычно исходят из фторсульфината калия, получаемого взаимодействием фторида калия и диоксида серы[1]:
SO2 + KF  KSO2F
KSO2F
Фторсульфинат калия далее может быть фторирован смесью фтора и воздуха в отношении 1:1 которую пропускают через никелевую трубку заполненную солью при температурах до 60—70°, выход почти количественный:
KSO2F + F2  SO2F2 + KF
SO2F2 + KF
Сульфурилфторид также может быть получен из фторсульфината натрия «безфторным» методом, в этом случае фторсульфинат натрия сначала хлорируется с образованием фторхлорсульфурила:
NaSO2F + Cl2  SO2ClF + NaCl
SO2ClF + NaCl
который далее вводится в реакцию с фторсульфинатом калия при 180 °C[2]:
SO2ClF + KSO2F  SO2F2 + KCl + SO2
SO2F2 + KCl + SO2
Сульфурилфторид с выходом 95-98% может быть получен фторированием двуокиси серы фторидом серебра (II) при 180°:
SO2 + 2AgF2  SO2F2 + 2AgF
SO2F2 + 2AgF
Сульфурилфторид также может быть получен термическим разложением фторсульфонатов двухвалентных металлов (бария, стронция и цинка, в случае фторсульфоната кальция при температуре разложения при 500° образуются лишь следовые количества сульфурилфторида):
Ba(OSO2F)2  BaSO4 + SO2F2
BaSO4 + SO2F2
Применение
Используется в сельском хозяйстве для борьбы с насекомыми, а также для фумигации зданий. Благодаря большей, чем у воздуха плотности, сульфурилфторид высокоэффективен против обитающих в земле насекомых, например, против муравьёв и термитов.
Поскольку сульфурилфторид интенсивно поглощает в инфракрасной области и медленно разлагается в атмосфере, то он потенциально является парниковым газом, однако вследствие малых масштабов производства он не вносит сколь либо заметной доли в парниковый эффект[3].
См. также
Примечания
- ↑ Seel, F. "Potassium Fluorosulfite" Inorganic Syntheses 1967, IX, pages 113-115. DOI:10.1002/9780470132401.ch29.
- ↑ Seel, F. "Sulfuryl Chloride Fluoride and Sulfuryl Fluoride" Inorganic Syntheses 1967, IX, pages 111-113.DOI:10.1002/9780470132401.ch28
- ↑ David Chandler. New greenhouse gas identified // MIT News, March 11, 2009
Литература
- Синтезы неорганических соединений, под ред. У. Джолли, том 3. М.: Мир, 1970
- George H. Cady. Fluorine-containing compounds of sulphur // Emeleus H.J. Advances in Inorganic Chemistry. — Academic Press. — ISBN 9780120236022
- Сульфурилгалогениды — Химическая энциклопедия (Советская энциклопедия).