Оксид урана(IV) | это... Что такое Оксид урана(IV)? (original) (raw)
| Оксид урана(IV) | |
|---|---|
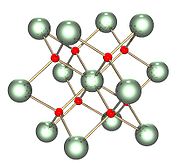 __ U4+ __ O2− __ U4+ __ O2− |
|
 |
|
 |
|
| Общие | |
| Систематическое наименование | Оксид урана(IV), Диоксид урана |
| Традиционные названия | Двуокись урана |
| Химическая формула | UO2 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое (в виде чёрного порошка) |
| Молярная масса | 270,03 г/моль |
| Плотность | 10,97 г/см³ |
| Термические свойства | |
| Температура плавления | 2875 °C |
| Молярная теплоёмкость (ст. усл.) | 63,6 Дж/(моль·К) |
| Теплопроводность (ст. усл.) | 4,5 Вт/(м·K) |
| Энтальпия образования (ст. усл.) | −1084,5 кДж/моль |
| Коэфф. тепл. расширения | 9,2·10−6 K−1 |
| Давление пара | в зависимости от температуры lg_p_=33,115T-4,026lgT+25,686 |
| Структура | |
| Координационная геометрия | Тетраэдрическая (O2−)кубическая (UIV), координационное число U[8], O[4] |
| Кристаллическая структура | кубическая,  , Fm3m, No. 225 , Fm3m, No. 225 |
| Классификация | |
| Рег. номер CAS | 1344-57-6 |
| Рег. номер EINECS | 215-700-3 |
| SMILES | O=U=O |
| RTECS | YR4705000 |
Оксид урана(IV) — неорганическое бинарное химическое соединение урана с кислородом — вещество тёмно-коричневого, почти чёрного, цвета. Химическая формула UO2 (точнее, UO2±x).
Свойства
Температура плавления в зависимости от стехиометрического состава составляет от 2840 до 2875 °C. Диоксид урана — нестехиометрическое соединение, имеющее состав от UO1,6 до UO2,5. Диоксид урана термодинамически устойчив при нагревании в вакууме или в востановительной атмосфере до температуры 1600 °C и возгоняется без разложения. При более высокой температуре он теряет кислород с образованием достехиометрического диоксида. В присутствии же кислорода, способен растворять его в себе с сохранением кубической структуры кристалла типа флюорита CaF2, причём дополнительные (сверх стехиометрии) атомы кислорода удерживаются в промежутках кристаллической решётки в результате внедрения атомов кислорода в решётку UO2 с образованием фазы UO2±x, где x зависит от температуры. При увеличении содержания кислорода цвет диоксида изменяется от тёмно-коричневого до чёрного[1].
Диоксид урана обладает сильно-основными свойствами, не реагирует с водой и её парами до 300 °C, не растворяется в соляной кислоте, но растворим в азотной кислоте, царской водке и смеси HNO3 и HF. При растворении в азотной кислоте происходит образование уранил-ионов UO2+2. Известен один кристаллогидрат диоксида урана UO2•2H2O — чёрный осадок, выпадающий при гидролизе растворов урана. Диоксид урана входит в состав урановых минералов уранинита и клевеита.
Применение
У диоксида урана нет фазовых переходов, он менее подвержен газовому распуханию, чем сплавы урана. Это позволяет повысить глубину выгорания до нескольких процентов. Диоксид урана не взаимодействует с цирконием, ниобием, нержавеющей сталью и другими материалами при высоких температурах.
Эти свойства позволяют применять его в ядерных реакторах, получая высокие температуры и, следовательно, высокий КПД реактора. ТВЭЛы из диоксида урана изготавливаются в виде брусков, трубок, таблеток и т. д. методами керамической технологии: холодным прессованием и выдавливанием с последующим спеканием изделий или горячим прессованием. В виде порошка диоксид урана диспергируется в металлических, графитовых или керамических матрицах. Основной недостаток керамики — низкая теплопроводность — 4,5 Вт/(м·К) (при температуре 800 °C). Кроме того, горячая керамика очень хрупка и может растрескиваться.
Диоксид урана, как и другие оксиды урана, используется также как промежуточный продукт при производстве других урановых соединений, главным образом фторидов урана. В общем, все оксиды урана являются наиболее устойчивыми соединениями урана, в связи с чем широко используются как для хранения урана, так и как промежуточное звено между урановорудным, аффинажно-металлургическим и фторидными урановыми производствами.
Получение
Диоксид урана можно получить, восстанавливая водородом высшие оксиды[1]:

или оксалат уранила:

Примечания
- ↑ 1 2 проф.И. Н. Бекман Уран. Учебное пособие. — М.: МГУ, 2009.
Литература
- Громов Б. В. Введение в химическую технологию урана. — М.: Атомиздат, 1978.
- Кац Дж., Рабинович Е. Химия урана: уран как элемент, его бинарные соединения, гидраты окислов и оксигалогениды. — М.: Иностранная литература, 1954.
- Шевченко В. Б., Судариков Б. Н. Технология урана. — М., 1961.
