Борная кислота | это... Что такое Борная кислота? (original) (raw)
| Борная кислота | |
|---|---|
 |
|
 |
|
 |
|
| Общие | |
| Систематическое наименование | Ортоборная кислота |
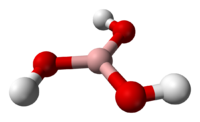
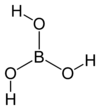
| Химическая формула | H3BO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Отн. молек. масса | 61,83 а. е. м. |
| Молярная масса | 61,83 г/моль |
| Плотность | 1,435 (15 °C) г/см³ |
| Термические свойства | |
| Температура плавления | 170.9 °C, 444 K, 340 °F °C |
| Температура кипения | 300 °C, 573 K, 572 °F °C |
| Химические свойства | |
| pKa | 9,24 (I), 12,74 (II), 13,80 (III) |
| Растворимость в воде | 2.52 (0 °C)4.72 (20 °C)5,74 (25 °C)19.10 (80 °C)27.53 (100 °C) г/100 мл |
| Классификация | |
| Рег. номер CAS | 10043-35-3 |
| Безопасность | |
| Токсичность |  0 2 0 0 2 0 |
Бо́рная кислота́ (ортоборная кислота) — слабая кислота, имеющая химическую формулу H3BO3.

структура плоского слоя в ортоборной кислоте
Бесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решетку, в которой молекулы кислоты соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями (d= 0,318 нм).
Метаборная кислота (HBO2) также представляет собой бесцветные кристаллы. Она существует в трех модификациях — наиболее устойчивой γ-НВО2 с кубической решеткой, β-НВО2 с моноклинной решеткой и α-НВО2 с ромбической решеткой.
При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту, затем в тетраборную H2B4O7. При дальнейшем нагревании обезвоживается до борного ангидрида.
Водные растворы борной кислоты являются смесью полиборных кислот общей формулы Н3m-2nВmО3m-n.
Свойства
Борная кислота проявляет очень слабые кислотные свойства. Она сравнительно мало растворима в воде. Ее кислотные свойства обусловлены не отщеплением протона Н+, а присоединением гидроксильного аниона:
![\mathsf{B(OH)_3 + H_2O \rightarrow H[B(OH)_4]}](http://dic.academic.ru/dic.nsf/ruwiki/f1e0960caa8f5645bf2a7555d4637f27.png)
_K_a = 5.8·10−10 моль/л; p_K_a = 9.24.
Она легко вытесняется из растворов своих солей большинством других кислот. Соли ее, называемые боратами, производятся обычно от различных полиборных кислот, чаще всего — тетраборной Н2В4О7, которая является значительно более сильной кислотой, чем ортоборная. Очень слабые признаки амфотерности B(OH)3 проявляет, образуя малоустойчивый гидросульфат бора В(HSO4)3.
При нейтрализации ортоборной кислоты щелочами в водных растворах не образуются ортобораты, содержащие ион (ВО3)3−, поскольку ортобораты гидролизуются практически полностью, вследствие слишком малой константы образования [В(ОН)4]−. В растворе образуются тетрабораты, метабораты или соли других полиборных кислот:

Избытком щелочи они могут быть переведены в метабораты:

Мета- и тетрабораты гидролизуются, но в меньшей степени (реакции, обратные приведенным).
В подкисленных водных растворах боратов устанавливаются следующие равновесия:
![\mathsf{3H[B(OH)_4] \rightleftarrows H^+ + [B_3O_3(OH)_4]^- + 5H_2O}](http://dic.academic.ru/dic.nsf/ruwiki/3b56a45b4b66706284c1d994936cf4c6.png)
![\mathsf{[B_3O_3(OH)_4]^- + OH^- \rightleftarrows [B_3O_3(OH)_5]^{2-} }](http://dic.academic.ru/dic.nsf/ruwiki/139853bd8ddc1eaf13ede6a7870a2d59.png)
Наиболее распространенной солью борной кислоты является декагидрат тетрабората натрия Na2B4O7·10H2O (техническое название — бура).
При нагревании борная кислота растворяет оксиды металлов, образуя соли.
Со спиртами в присутствии концентрированной серной кислоты образует эфиры:

Образование борнометилового эфира В(ОСН3)3 является качественной реакцией на Н3ВО3 и соли борных кислот, при поджигании борнометиловый эфир горит красивым ярко-зеленым пламенем.
Нахождение в природе
В природе свободная борная кислота встречается в виде минерала сассолина, в горячих источниках и минеральных водах.
Применение
- В ядерных реакторах в качестве поглотителя нейтронов, растворённого в теплоносителе.
- Борное удобрение
- В лабораториях применяют для приготовления буферных растворов
- В медицине — как самостоятельное дезинфицирующее средство, а также в виде 2% раствора - для промывки кожи после попадания щелочей
- Также на основе борной кислоты производятся различные комбинированные препараты (группа АТХ D08AD), например, паста Теймурова.
- В фотографии — в составе мелкозернистых проявителей и кислых фиксажей для создания слабой кислотной среды.
- В быту используется для борьбы с тараканами.
- В пищевой промышленности — зарегистрирована как пищевая добавка E284 (на территории России эта добавка не входит в список разрешённых к применению[1]).
- В игре Новус борной кислотой натирают игровой стол для лучшего скольжения фишек.
- В ювелирном деле — как основа флюсов для пайки золото-содержащих сплавов.
- В промышленности - связующее при кислой футеровке печей.
См. также
Примечания
Литература
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия 1994
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Прозоровский. В. КОВАРНАЯ БОРНАЯ КИСЛОТА. Журнал «Наука и жизнь» № 11, 2003 год
| Соединения бора |
|---|
| Арсенид бора (BAs) • Боразол (B3N3H6) • Борная кислота (H3BO3) • Борогидрид натрия (NaBH4) • Диборан (B2H6) • Карбид бора (B4C) • Метаборат натрия (NaBO2) • Нитрид бора (BN) • Оксид бора (B2O3) • Пентаборат натрия (NaB5O8) • Субоксид бора (B6O) • Сульфид бора (B2S3) • Тетраборан (B4H10) • Тетраборат натрия (Na2B4O7) • Тетрагидридоборат лития (Li[BH4]) • Тетрафторид бора (B2F4) • Тетрафтороборат водорода (H[BF4]) • Тетрафтороборат натрия (Na[BF4]) • Трибромид бора (BBr3) • Трииодид бора (BI3) • Трифторид бора (BF3) • Трихлорид бора (BCl3) • Фосфид бора (BP) |
