Портальная гипертензия | это... Что такое Портальная гипертензия? (original) (raw)
| Портальная гипертензия | ||
|---|---|---|
 |
||
| МКБ-10 | K76.676.6 | |
| МКБ-9 | 572.3572.3 | |
| DiseasesDB | 10388 | 10388 |
| eMedicine | radio/570 med/1889med/1889 | radio/570 med/1889med/1889 |
| MeSH | D006975 | D006975 |
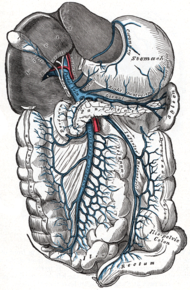
Порта́льная гиперте́нзия — синдром повышенного давления в системе воротной вены, вызванного нарушением кровотока в портальных сосудах, печёночных венах и нижней полой вене.
Содержание
- 1 Общее
- 2 Терапия
- 3 История применения хирургического метода терапии
- 4 Рекомендуемая литература
- 5 Ссылки
Общее
Портальная гипертензия сопровождается спленомегалией (увеличением селезенки), варикозным расширением вен пищевода и желудка, асцитом, печеночной энцефалопатией (печеночной недостаточностью).
В норме давление в системе портальных вен составляет 5-10 мм рт.ст. Повышение давления в системе портальных вен выше 12 мм рт.ст. свидетельствует о развитии портальной гипертензии. Варикозное расширение вен возникает при давлении в портальной системе больше 12 мм рт. ст.
В большинстве случаев портальная гипертензия является следствием цирроза печени, шистосоматоза (в эндемичных районах), структурных аномалий печеночных сосудов.
Если при портальной гипертензии давление в малой печеночной вене больше или равно 12 мм рт. ст., между портальной системой и системной венозной сетью возникает коллатеральное кровообращение. По коллатералям (варикозам) отводится часть портального кровотока от печени, что способствует уменьшению портальной гипертензии, но никогда полностью не устраняет её. Коллатерали возникают в местах близкого расположения ветвей портальной и системной венозной сети: в слизистой оболочке пищевода, желудка, прямой кишки; на передней брюшной стенке (между пупочными и эпигастральными венами).
Диагноз портальной гипертензии устанавливается на основании данных клинической оценки, визуализирующих методов обследования и эндоскопии.
Лечение заключается в медикаментозных и эндоскопических мероприятиях, направленных на профилактику кровотечений из расширенных вен пищевода, желудка, кишечника. К хирургическим методам терапии относится портосистемное шунтирование.
Терапия
Вряд ли найдется другая болезнь, для лечения которой было бы предложено столь много оперативных вмешательств, каковым является портальная гипертензия (ПГТ). Данное обстоятельство свидетельствует о чрезвычайной сложности проблемы ПГТ и о неудовлетворенности хирургов результатами операций, что и обусловливает постоянный поиск более эффективных методов лечения этого заболевания.
Хирургическое лечение
Основное показание к операции при ПГТ — лечение и профилактика кровотечений из варикозно расширенных вен (ВРВ) пищевода и желудка, являющихся главной причиной летального исхода. Указанному симптому «обязан» практически весь арсенал хирургических пособий, применяемых при этой болезни. Именно этим симптомом ПГТ объясняется повышенный интерес хирургов к обсуждаемой проблеме.
К 1980 г. общее количество разработанных операций и их модификаций при ПГТ превышало 100. В последующие годы их количество увеличилось. Однако в связи с развитием и внедрением в клиническую практику ортотопической трансплантации печени характер их изменился благодаря появлению «малоинвазивных» эндоваскулярных и эндоскопических технологий, позволяющих получить недолгосрочный гемостатический эффект.
В России трансплантация печени делает лишь первые шаги. Поэтому хирургические методы лечения ПГТ ещё долгое время будут иметь первостепенное значение. Что же касается внепеченочной портальной гипертензии (ВПГТ), то альтернативы оперативному лечению этой патологии нет.
История применения хирургического метода терапии
Началом хирургического лечения ПГТ следует считать 80-90-е годы XIX века, когда за основу оперативного вмешательства была взята идея декомпрессии портальной системы, то есть создания новых путей оттока крови из системы воротной вены.
Для решения этой задачи почти одновременно были предложены два типа операций:
- оментопариетопексия (то есть подшивание большого сальника к передней брюшной стенке), предложенная голландским врачом A.S. Talma (1898);
- сосудистый портокавальный анастомоз (ПКА), разработанный отечественным хирургом Н. В. Экком в 1877 г..
Идея Talma дала начало новому направлению в хирургии ПГТ, названному органоанастомозами. Его сторонники использовали для этой цели не только сальник, фиксируя его к печени, почке и полой вене, но и такие органы, как тонкая кишка, желудок, печень, селезенка. Они подшивали их в зависимости от уровня блока друг к другу, легкому, диафрагме, мышцам или брюшной стенке.
Сравнительно простая техника указанных операций способствовала их широкому распространению в клинической практике. Подавляющая часть хирургов совмещала их со спленэктомией или перевязкой селезеночной артерии, мотивируя такую комбинацию тремя обстоятельствами:
- уменьшением притока крови в портальную систему, а, следовательно, и снижением портального давления;
- улучшением артериального кровообращения печени вследствие перераспределения потока крови в системе чревной артерии, что должно было улучшить функцию цирротической печени;
- коррекцией гиперспленизма, часто сопутствующего спленомегалии.
Спленэктомия сопровождалась высокой послеоперационной летальностью. Её причинами являлись тромбоз сосудов портальной системы с последующим кровотечением из пищевода и желудка и печеночная недостаточность. В немалой степени печеночная недостаточность обусловливалась также интраоперационной кровопотерей, достигавшей в ряде случаев 2 л и более крови. Попытки её уменьшения путем предварительной перевязки селезеночной артерии или дооперационной эмболизации артериального притока к селезенке ощутимых результатов не дали.
Будучи же благополучно перенесенной, спленэктомия иногда осложнялась новым, ещё более тяжелым страданием — аспленической геморрагической тромбоцитемией, требующей новых лечебных подходов.
В связи с неэффективностью указанных операций при кровотечениях из ВРВ пищевода и желудка в хирургии ПГТ появилась новая проблема — проблема повторных операций, приобретшая особую актуальность для больных с ВПГТ, которые в отличие от больных циррозом печени (ЦП) имеют практически нормальную функцию этого органа, а при отсутствии кровотечений — продолжительность жизни, не отличающуюся от таковой у здоровых людей.
Перенеся несколько операций, выполненных в других лечебных учреждениях, эти больные поступали в наше отделение в связи с продолжающимися рецидивами кровотечения из ВРВ пищевода и желудка без всякой надежды на успех.
Эзофагогастрэктомия
Первые операции частичной эзофагогастрэктомии в клинике ... выполнены профессором М. Д. Пациора в 1960—1965 гг. Однако из 9 больных 4 умерли от несостоятельности швов пищеводно-желудочного анастомоза. И только с 1968 г., после внедрения в практику К. Н. Цацаниди инвагинационного метода пищеводного соустья, непосредственные результаты этой операции значительно улучшились.
По данным мировой литературы 1960—1970 гг., на эту операцию возлагались большие надежды как на наиболее радикальную и последнюю попытку остановить кровотечение из флебэктазов пищевода и желудка, когда шунтирующие операции оказывались невыполнимыми.
В 70-80-е годы прошлого века выполнимость сосудистых ПКА во многом сдерживалась отсутствием соответствующего шовного материала и бытовавшим в то время мнением о непригодности сосудов малых диаметров (8-10 мм) для адекватной декомпрессии портальной системы. Поэтому частота ПКА среди всех хирургических вмешательств не превышала 15 %.
С накоплением опыта и внедрением в практику элементов микрохирургической техники позднее частота выполнимости портокавальных шунтов значительно возросла. В настоящее время у больных ЦП она составляет 30-35 %, а у больных ВПГТ — 50-55 %, что позволило значительно улучшить результаты операций по профилактике кровотечений из ВРВ пищевода и желудка.
Начиная с 1980 г. отношение к спленэктомии как к самостоятельной операции, было ревизовано: резко сужены показания к её выполнению и ограничено их применение наличием трех ситуаций:
- сегментарной портальной гипертензии, когда основным проявлением болезни стали профузные кровотечения из ВРВ желудка в результате непроходимости селезеночной вены;
- артериовенозной фистулы между селезеночной артерией и селезеночной веной, то есть когда причиной ПГТ является нагрузка объёмом крови;
- инфантилизма у подростков, имеющих ЦП, когда удаление селезенки больших размеров ведет к нормализации физических параметров организма.
Гиперспленизм, то есть нарушение состава периферической крови, в настоящее время не рассматривается как настоятельное показание к спленэктомии, ибо повышение числа тромбоцитов и лейкоцитов после удаления селезенки не влияет на течение ПГТ, а в ряде случаев ухудшает прогноз болезни, о чём указывалось выше.
В случаях, когда слишком большие размеры селезенки препятствуют прямому вмешательству на ВРВ пищевода и желудка, выполняемому с целью лечения или профилактики гастроэзофагеальных кровотечений, а ПКА не показан или невыполним, спленэктомию можно признать оправданной операцией, без которой основное вмешательство оказалось бы неосуществимым.
Идея шунтирования портальной системы у больных ЦП сохраняет свою актуальность и в настоящее время. Однако накопленный мировой и собственный опыт (более 450 операций за последние 20 лет) показал, что прямые ПКА между воротной и нижней полой венами, радикально излечивая больного ЦП от портальной гипертензии, как правило, ухудшают функцию печени, вследствие чего нередко развивается печеночная энцефалопатия и наступает смерть больного. Вот почему интерес к шунтирующим операциям у больных ЦП надолго угас. Вновь он возродился только после 50-х годов прошлого столетия, когда были предложены ПКА с корнями воротной вены — селезеночным и брыжеечным сосудами.
Однако и они сопровождались значительным числом осложнений, среди которых печеночной энцефалопатии принадлежит основная роль. Позднее, в 1967 г., W.D. Warren была предложена операция дистального спленоренального анастомоза (ДСРА), суть которой сводилась к шунтированию селезеночно-желудочного бассейна при сохранении кровотока по воротной вене. Благодаря этому значительно улучшились результаты шунтирующих операций.
К этому времени стало ясно, что, осуществляя декомпрессию портальной системы при ЦП, следует сохранять кровоток по воротной вене и что ДСРА позволяет решить эту дилемму. Однако анатомические условия редко позволяли выполнить такой тип анастомозов. Кроме того, серьёзным, а иногда и смертельным осложнением этой операции был послеоперационный панкреатит.
Вот почему в последующие годы в мировой практике с 1990 г. получили распространение так называемые парциальные сосудистые ПКА. Основная их идея — ограничение диаметра создаваемого портокавального соустья. В результате достигается не полный, а парциальный, то есть частичный, сброс портальной крови и сохраняется остаточный проградный кровоток к печени. Практика показала, что оптимальный диаметр такого соустья должен находиться в пределах 8-10 мм.
При удобном расположении селезеночной вены операцией выбора может быть ДСРА. Считаем, что для больных ЦП мезентерико-кавальный шунт менее предпочтителен из-за более высокого риска развития энцефалопатии. Однако иногда он является единственно возможным по анатомическим условиям.
Отбор больных
Отбор больных ЦП для выполнения ПКА — ответственный момент. Биохимические характеристики больных должны соответствовать параметрам класса А по Чайльду, а значения маркеров цитолиза — нормальным. Кроме того, сократительная функция миокарда должна быть в пределах нормы.
Если же выявлены небольшие отклонения биохимических показателей, а больной может быть отнесен ближе к классу В или соответствует ему при нормальных показателях сократительной функции миокарда, то следует очень взвешенно оценить наличие латентной энцефалопатии, выявление которой считается абсолютным противопоказанием к наложению шунта.
Кроме того, в последние 10 лет мы придаем важное значение и показателям объемного кровотока по воротной вене. Исследования, проведенные в отделении функциональной диагностики РНЦХ РАМН (Камалов Ю. Р. и др., 1999), показали, что объемный кровоток по воротной вене у здоровых лиц составил в среднем 897,0+220,8 мл/мин, а у больных ЦП, обследованных перед наложением сосудистого анастомоза, — 739,75+311,66 мл/мин (p>0,05).
Ретроспективный анализ показал, что после выполнения парциального шунта (спустя 14-16 дней после операции) кровоток плохо определялся или не определялся у тех больных, у которых исходно был ниже 500 мл/мин. Так, из 46 больных с наложенными парциальными шунтами при выписке из отделения кровоток по воротной вене не определялся у 8 (до операции был равен 500 мл/мин или ниже).
В отдаленный период, то есть спустя 6 мес — 14 лет, из 39 больных ЦП и с парциальными сосудистыми анастомозами кровоток по воротной вене сохранился у 22, у 17 он не определялся. Только у 3 из 17 больных результат операции оценен как неудовлетворительный: прогрессировала печеночная недостаточность, а в последующем наступил летальный исход.
Итак, парциальные анастомозы не гарантируют сохранения проградного кровотока к печени как в ближайший, так и в отдаленный период. Однако клинические результаты их несопоставимы с тотальными ПКА, при которых портальный кровоток сразу или почти сразу прекращается. Вследствие этого после операции может резко ухудшиться функция печени сразу, а в последующем развиться печеночная недостаточность и наступить смерть больного.
Современная хирургическая терапия
Показано, что частичная декомпрессия портальной системы у большинства больных сохраняет приток портальной крови к печени, хотя и редуцированный. У тех же пациентов, у которых он не определялся, его угасание, как мы полагаем, происходило более или менее длительное время, достаточное для адаптации печени к изменившимся условиям гемодинамики.
При изучении отдаленных клинических результатов парциальных ПКА у 78 больных ЦП в сроки от 6 мес до 14 лет констатировали развитие энцефалопатии в легкой форме у 23 %. Трудоспособность сохранилась у 83 % больных, работавших до операции. Пережили 2-летний срок с момента операции 75 % больных, 3-летний — 60 %, 5-летний — 50 %.
Основная причина смерти в отдаленный период — прогрессирование ЦП (19 больных) и рецидив кровотечения вследствие тромбоза анастомоза (4 пациента). Из 19 больных 9 умерли в течение первого года после операции. До операции все они относились к классу В по Чайльду и имели несколько повышенные значения маркеров цитолиза.
При невыполнимости сосудистого анастомоза или при противопоказаниях к его выполнению профилактика и лечение кровотечений из ВРВ пищевода и желудка осуществляются путем модифицированной М. Д. Пациора операции Таннера — прошиванием и перевязкой ВРВ дистального отдела пищевода и проксимального отдела желудка путем гастротомии, выполняемой как из абдоминального доступа, так и из торакального.
Из многочисленных операций подобного типа, предложенных в мире, в России именно эта наиболее распространена как технически простая и непродолжительная по времени.
В последние 20 лет нами выполнены 683 таких операции, из них в плановом порядке — 428 (62,7 %) с общей послеоперационной летальностью 27,5 %. При этом у больных ЦП она составила 22 %, с ВПГТ — 5,5 %.
Комбинация этой операции со спленэктомией значительно повышала частоту послеоперационных осложнений и летальных исходов. После ограничения показаний к спленэктомии летальность снизилась и начиная с 1990 г. уже не превышала 12-15 %.
При операциях по срочным показаниям, то есть в период продолжающегося кровотечения, у 155 больных послеоперационная летальность достигла 48,9 %. У больных ЦП она составила 32,9 %, а с ВПГТ — 16 %. Послеоперационная летальность больных ЦП, как правило, обусловливалась прогрессирующей печеночной недостаточностью, а с ВПГТ — полиорганной недостаточностью и гнойно-септическими осложнениями.
Отдаленные результаты в сроки от 1 года до 10 лет изучены у 218 больных ЦП и 257 — с ВПГТ. Рецидивы кровотечений отмечены у 114 (52,3 %) больных ЦП, что явилось причиной смерти 38 пациентов. У 102 (39,7 %) больных с ВПГТ наступили рецидивы кровотечений, явившиеся причиной смерти у 19.
Следует отметить, что рецидивы кровотечений после операции у большинства больных имели менее тяжелый характер, чем до операции. Как правило, поступившим в отделение больным ЦП по поводу рецидивов кровотечения назначали эндоскопическое исследование, а затем склеротерапию ВРВ пищевода. Что касается больных с ВПГТ, то в связи с рецидивами кровотечений 52 выполнены повторные операции: 32 — повторное прошивание ВРВ пищевода и желудка, а 20 — сосудистый анастомоз.
После прошивания ВРВ 5-летняя выживаемость у больных ЦП класса А по Чайльду составила 73 %, класса В — 55 %. У больных с ВПГТ 5-летняя выживаемость составила 90,5 %.
Через 6 мес после прошивания ВРВ рекомендуется эндоскопический контроль результатов операции. Оставшиеся или вновь появившиеся у ряда больных ВРВ пищевода подвергаются превентивной эндоскопической склеротерапии.
Особо следует остановиться на алгоритме лечения при острых кровотечениях из ВРВ пищевода и желудка. Последовательность действий хирурга сводится к следующему. После эндоскопической диагностики и распознавания варикозных вен как источника кровотечения немедленно вводится зонд Сенгстакена-Блекмора, что дает возможность остановить кровотечение в 95 % случаев.
Одновременно проводится интенсивная заместительная инфузионно — трансфузионная терапия, оценивается функциональное состояние печени. Для этого используется широко распространенная классификация по Чайльду.
После стабилизации гемодинамики подключается внутривенное введение препаратов нитроглицерина для снижения портального давления и пролонгирования гемостатического эффекта зонда. В течение этого времени желудок отмывается от крови. Через 6 ч воздух из желудочной манжетки выпускается. Если кровотечение не рецидивирует, то больному осуществляется попытка эндоскопического склерозирования ВРВ.
Если после распускания желудочной манжетки возникает рецидив кровотечения, то дальнейшие действия зависят от тяжести течения ЦП. Больным классов А и В (по Чайльду) прошиваются ВРВ пищевода и желудка.
Если же это больной класса С, то вновь раздувается желудочная манжетка и проводятся гемостатические мероприятия, в частности переливание свежезамороженной плазмы и гемостатиков. После достижения временного гемостаза проводится эндоскопическое склерозирование с надеждой добиться окончательного гемостаза. Если после эндоскопического тромбирования у больных классов А и В вновь рецидивирует кровотечение, то снова вводится зонд Сенгстакена-Блекмора, и больной доставляется в операционную для прошивания ВРВ пищевода и желудка.
В 90-е годы нами накоплен опыт чреспеченочного эндоваскулярного тромбирования внеорганных вен желудка. Технология метода сложна, требует дорогостоящей аппаратуры и высокого мастерства хирурга, что сдерживает её широкое применение. Следует отметить, что эта манипуляция дает надежный, но временный гемостатический эффект, и вероятность рецидивов кровотечения сохраняется.
Подводя итог, можно признать, что лечение и профилактика кровотечений из ВРВ пищевода и желудка по-прежнему составляет основу показаний для хирургического вмешательства при ПГТ. Испытав практически весь арсенал хирургических пособий при лечении ПГТ, в последние 10 лет мы выбрали 2 вида операций — парциальные сосудистые ПКА и прямые вмешательства на ВРВ пищевода и желудка.
Накопленный опыт показал, что сосудистые анастомозы следует признать операцией выбора для больных ЦП класса А по Чайльду без признаков активности и с удовлетворительными параметрами центральной и печеночной гемодинамики. Для больных ЦП класса В этот вопрос остается пока предметом исследования. Основная летальность приходится именно на эту категорию больных в первый год после операции в связи с прогрессированием печеночной недостаточности.
Вот почему 5-летняя выживаемость больных ЦП после сосудистых анастомозов не превысила 50 %. Есть все основания полагать, что она оказалась бы существенно выше, если бы парциальные сосудистые анастомозы выполнялись только у больных класса А.
Что касается больных с ВПГТ, то вопрос о показаниях к ПКШ у них уже не обсуждается. Этот вид хирургического пособия для них однозначно является операцией выбора. При его невыполнимости операцией выбора остается только прошивание ВРВ как из абдоминального доступа, так и из торакального. Риск рецидива кровотечения после этой операции сохраняется. Однако по этому поводу может быть предпринята повторная операция такого же типа или эндоскопическое пособие.
В отличие от резекции пищевода и желудка эта операция не приводит к более тяжелой инвалидизации больных и не ухудшает качества их жизни. Однако в отдельных случаях нельзя исключить возможность гастрэктомии, когда сосудистый шунт невыполним, а доминирующим симптомом являются ВРВ желудка и гастропатия. Такое вмешательство может рассматриваться как операция выбора у ранее не оперированных больных.
В последние годы иногда нам удается выполнить в качестве повторной операции сосудистые ПКА, которые полностью решают проблему ВПГТ.
Эндоскопическое склерозирование ВРВ, как правило, носит вспомогательный характер и применяется в основном при угрозе рецидива кровотечения после операции. При наличии отдельных стволов ВРВ или узлов, доступных для введения склерозантов, целесообразно ограничиться только этой процедурой с последующим контролем через 5-6 мес за состоянием флебэктазов.
Многолетний опыт свидетельствует о том, что после установления диагноза «портальная гипертензия» (чаще всего в терапевтической клинике), больной должен быть направлен в специализированное отделение как можно раньше до возникновения кровотечения, при котором операция дает более высокую летальность.
Опытный эндоскопист должен оценить состояние ВРВ пищевода и желудка и риск развития кровотечения и передать эту информацию клиницисту, который решает вопрос о дальнейшей тактике. При показаниях к операции хирургу необходимо выбрать метод хирургического пособия, адекватный функциональному состоянию печени, центральной и портальной гемодинамике. В конечном итоге это и определяет выживаемость такой категории больных.
Возможность медикаментозной коррекции кровотечений из ВРВ пищевода и желудка, о чём имеется масса сообщений в зарубежной литературе, согласно собственному первому опыту, нам представляется преувеличенной. В настоящее время эту проблему мы продолжаем изучать.
Рекомендуемая литература
- Ерамишанцев А. К. Развитие проблемы хирургического лечения кровотечений из варикозно расширенных вен пищевода и желудка // Анн. хир. гепатол. — 2007. -Т.12, № 2. — С.8-16.
- Шерцингер А. Г., Жигалова С. Б., Мусин Р. А. и др. Осложнения после эндоскопических вмешательств у больных портальной гипертензией // Анн. хир. гепатол. — 2007. — Т.12, № 2. — С.16-21.
- Гарбузенко Д. В. Лечебная тактика при кровотечениях из варикозно расширенных вен желудка // Анн. хир. гепатол. — 2007. — Т.12, № 1.- С.96-103.
- Лебезев В. М., Ерамишанцев А. К., Григорян Р. С. Сочетанные операции в профилактике гастроэзофа-геальных кровотечениий у больных с портальной гипертензией // Анн. хир. гепатол. — 2006. — Т.11, № 2. — С.16-20.
- Гарбузенко Д. В. Фармакотерапия портальной гипертензии // Клинич. медицина.- 2004.- № 3. — С.16-20
- Гарбузенко Д. В. Профилактика кровотечений из варикозно расширенных вен пищевода и желудка у больных циррозом печени // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2004. — Т. 14, № 4. — С. 8-14.
- Ерамишанцев А. К., Киценко Е. А., Нечаенко А. М. Операции на пищеводе и желудке у больных с портальной гипертензией // Клинич. перспективы гастроэнтерол., гепатол. — 2002. — № 6. — С.8-14.
- Гарбузенко Д. В. Патогенез портальной гипертензии при циррозе печени // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2002. — Т. 12, № 5. — С. 23-29.
- Пациора М. Д. Хирургия портальной гипертензии. — Ташкент : Медицина, 1984. — 319 с.
- Углов Ф. Г., Корякина Т. О. Хирургическое лечение портальной гипертензии. — Л. : Медицина, 1964. — 220 с.