Окисление | это... Что такое Окисление? (original) (raw)
Окисление
Окисление
Окисли́тельно-восстанови́тельные реа́кции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Содержание
- 1 Описание
- 2 Виды окислительно-восстановительных реакций
- 3 Примеры
- 4 Мнемонические правила
- 5 См. также
- 6 Ссылки
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель - e− ↔ сопряжённый окислитель.
Виды окислительно-восстановительных реакций
- межмолекулярные - реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 ---> S + 2HCl
- внутримолекулярные - реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
NH4NO3 ---> N2O + 2 H2O
- диспропорционирование (самоокисление-самовосстановление) - реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления:
M+N ---> M+(N-x) + M+(N+x)
Примеры
Окислительно-востановительная реакция между водородом и фтором
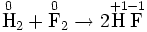
Разделяется на две полуреакции:Ы
- Окисление:
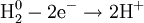
- Восстановление:
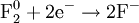
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
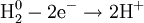

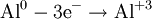
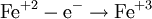
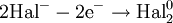
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
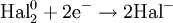
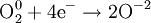

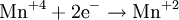
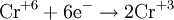
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Мнемонические правила
Для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:
- Отдать - Окислиться, Взять - Восстановиться (слова начинаются с одинаковых букв; при отдавании кем-либо чего-либо полезного - кислое, опущенное выражение лица, при получении - воспрявшее, восстановленное).
- Окислитель - грабитель (в процессе окислительно-восстановительной реакции окислитель присоединяет электроны).
См. также
- Окислитель
- Восстановитель
- Электролиз
- Электрохимия
- Окислительно-восстановительные реакции в биохимии
Ссылки
Wikimedia Foundation.2010.
Синонимы:
Полезное
Смотреть что такое "Окисление" в других словарях:
- Окисление — Окисление. В области научной терминологии широко и наглядно сказалась огромная словообразующая роль словарного фонда. Из слов, принадлежащих к основному словарному фонду и выражающих очень конкретные бытовые значения, создавались новые… … История слов
- ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, химическая реакция присоединения кислорода или отнятия водорода. Для ионных процессов общепринята более расширенная формулировка: О. есть увеличение положительной валентности (заряда> или уменьшение отрицательной валентности… … Большая медицинская энциклопедия
- окисление — – окисление масла – в работающем двигателе горячее масло постоянно циркулирует и контактирует с воздухом, продуктами полного и неполного сгорания топлива. Кислород воздуха ускоряет окисление масла. EdwART. Словарь автомобильного жаргона, 2009 … Автомобильный словарь
- ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, химическая реакция, включающая потерю атомом или молекулой одного или более ЭЛЕКТРОНОВ (всегда является частью реакции ОКИСЛЕНИЯ ВОССТАНОВЛЕНИЯ, при которой эти электроны приобретаются другим атомом или молекулой). Раньше этот термин… … Научно-технический энциклопедический словарь
- окисление — оксидировка, оксидация, окисание, оксидирование, фотолиз Словарь русских синонимов. окисление сущ., кол во синонимов: 9 • автоокисление (2) • … Словарь синонимов
- ОКИСЛЕНИЕ — в химии см. Окислительно восстановительные реакции … Большой Энциклопедический словарь
- ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, окисления, мн. нет, ср. (хим.). Химический процесс, при котором происходит соединение какого нибудь тела с кислородом. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
- ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, я, ср. (спец.). Химическая реакция соединения вещества с кислородом или с другим веществом, способным принимать электроны. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
- окисление — Ндп. пережог рубашка Дефект в виде окисленного слоя металла с поверхности отливки, получившийся после отжига отливок из белого чугуна на ковкий чугун. [ГОСТ 19200 80] Недопустимые, нерекомендуемые пережогрубашка Тематики отливки из чугуна и стали … Справочник технического переводчика
- окисление — Одна из разновидностей химического выветривания, особенно в горных породах, содержащих железо, в результате которого скальная поверхность приобретает коричневатый или желтоватый цвет и соответственно разрушается … Словарь по географии
- окисление — – 1. Процесс взаимодействия с кислородом. 2. Процесс передачи электронов восстановителем в ходе окислительно восстановительной реакции. Словарь по аналитической химии [3] … Химические термины