Оксид кремния(IV) | это... Что такое Оксид кремния(IV)? (original) (raw)

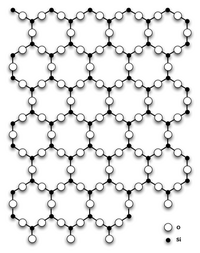
Кварц

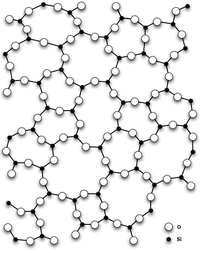
Кварцевое стекло
Oксид кремния (IV) (диоксид кремния, кремнезём SiO2) — бесцветные кристаллы, tпл 1713—1728 °C, обладают высокой твёрдостью и прочностью.
Содержание
- 1 Свойства
- 2 Полиморфизм
- 3 Химические свойства
- 4 Получение
- 5 Применение
- 6 Пористые кремнезёмы
- 7 Литература
Свойства
- Относится к группе кислотных оксидов.
- При нагревании взаимодействует с основными оксидами и щелочами.
- Растворяется в плавиковой кислоте.
- SiO2 относится к группе стеклообразующих оксидов, то есть склонен к образованию переохлажденного расплава — стекла.
- Один из лучших диэлектриков (электрический ток почти не проводит).
- Имеет атомную кристаллическую решетку.
Полиморфизм
Диоксид кремния имеет несколько полиморфных модификаций.
Самая распространенная из них на поверхности земли — α-кварц — кристаллизуется в тригональной сингонии
При нормальных условиях диоксид кремния чаще всего находится в полиморфной модификации α-кварца, которая при температуре выше 573 °C обратимо переходит в β-кварц. При дальнейшем повышении температуры кварц переходит в тридимит и кристобалит. Эти полиморфные модификации устойчивы при высоких температурах и низких давлениях. При высоких температуре и давлении диоксид кремния сначала превращается в коэсит (который в 1953 был синтезирован американским химиком Лорингом Коэсом), а затем в стишовит (который в 1961 году был синтезирован С. М. Стишовым, а в 1962 был обнаружен в метеоритном кратере)[источник не указан 506 дней]. Согласно некоторым исследованиям стишовит слагает значительную часть мантии, так что вопрос о том какая разновидность SiO2 наиболее распространена на Земле, пока не имеет однозначного ответа.
Также имеет аморфную модификацию — кварцевое стекло.
Химические свойства
Диоксид кремния SiO2 — кислотный оксид, не реагирующий с водой.
Химически стоек к действию кислот, но реагирует с газобразным фтороводородом:

![\mathsf{SiO_2 + 6HF \rightarrow H_2[SiF_6] + 2H_2O}](https://dic.academic.ru/dic.nsf/ruwiki/f7b5e1f03c99f8df024ab3e533f8cd18.png)
Эти две реакции широко используют для травления стекла.
При сплавлении SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли не имеющих постоянного состава очень слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2 (довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая кислота, хотя фактически речь при этом идет об одном и том же веществе).
Например, может быть получен ортосиликат натрия:

метасиликат кальция:

или смешанный силикат кальция и натрия:

Из силиката Na2CaSi6O14 (Na2O·CaO·6SiO2) изготовляют оконное стекло.
Следует отметить, что большинство силикатов не имеет постоянного состава. Из всех силикатов растворимы в воде только силикаты натрия и калия. Растворы этих силикатов в воде называют жидким стеклом. Из-за гидролиза эти растворы характеризуются сильно щелочной средой. Для гидролизованных силикатов характерно образование не истинных, а коллоидных растворов. При подкислении растворов силикатов натрия или калия выпадает студенистый белый осадок гидратированных кремниевых кислот.
Главным структурным элементом как твердого диоксида кремния, так и всех силикатов, выступает группа [SiO4/2], в которой атом кремния Si окружен тетраэдром из четырёх атомов кислорода О. При этом каждый атом кислорода соединен с двумя атомами кремния. Фрагменты [SiO4/2] могут быть связаны между собой по-разному. Среди силикатов по характеру связи в них фрагментов [SiO4/2] выделяют островные, цепочечные, ленточные, слоистые, каркасные и другие.
Получение
Синтетический диоксид кремния получают нагреванием кремния до температуры 400—500 °C в атмосфере кислорода, при этом кремний окисляется до диоксида SiO2. А также термическим оксидированием при больших температурах.
В лабораторных условиях синтетический диоксид кремния может быть получен действием кислот, даже слабой уксусной, на растворимые силикаты. Например:

кремниевая кислота сразу распадается на воду и SiO2, выпадающий в осадок.
Натуральный диоксид кремния в виде песка используется там, где не требуется высокая чистота материала.
Применение
Диоксид кремния применяют в производстве стекла, керамики, абразивов, бетонных изделий, для получения кремния, как наполнитель в производстве резин, при производстве кремнезёмистых огнеупоров, в хроматографии и др. Кристаллы кварца обладают пьезоэлектрическими свойствами и поэтому используются в радиотехнике, ультразвуковых установках, в зажигалках.
Диоксид кремния — главный компонент почти всех земных горных пород, в частности, кизельгура. Из кремнезёма и силикатов состоит 87 % массы литосферы.
Аморфный непористый диоксид кремния применяется в пищевой промышленности в качестве вспомогательного вещества E551, препятствующего слёживанию и комкованию, парафармацевтике (зубные пасты), в фармацевтической промышленности в качестве вспомогательного вещества (внесён в большинство Фармакопей), а также пищевой добавки или лекарственного препарата в качестве энтеросорбента.
Искусственно полученные плёнки диоксида кремния используются в качестве изолятора при производстве микросхем и других электронных компонентов.
Также используется для производства волоконно-оптических кабелей. Используется чистый плавленый диоксид кремния с добавкой в него некоторых специальных ингредиентов.
Кремнезёмная нить также используется в нагревательных элементах электронных сигарет, так как хорошо впитывает жидкость и не разрушается под нагревом спирали.
Пористые кремнезёмы
Пористые кремнезёмы получают различными методами.
Силохром получают путём агрегирования аэросила, который, в свою очередь, получают сжиганием силана (SiH4). Силохром характеризуется высокой чистотой, низкой механической прочностью. Характерный размер удельной поверхности 60—120 м²/г. Применяется в качестве сорбента в хроматографии, наполнителя резин, катализе.
Силикагель получают путём высушивания геля кремневой кислоты. В сравнении с силохромом обладает меньшей чистотой, однако может обладать чрезвычайно развитой поверхностью: до 320 м²/г.
Кремниевый аэрогель приблизительно на 99,8 % состоит из воздуха может иметь плотность до 1,9 кг/м³ (всего в 1,5 раза больше плотности воздуха).
Литература
- Кнунянц И. Л. и др. т.2 Даффа-Меди // Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5