Фторид ксенона(II) | это... Что такое Фторид ксенона(II)? (original) (raw)
| Фторид ксенона(II) | |
|---|---|
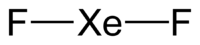 |
|
 |
|
| Общие | |
| Систематическое наименование | Фторид ксенона(II) |
| Химическая формула | XeF2 |
| Физические свойства | |
| Состояние (ст. усл.) | белые кристаллы |
| Отн. молек. масса | 169 а. е. м. |
| Молярная масса | 169,2968 г/моль |
| Плотность | 4,32 г/см³ |
| Термические свойства | |
| Температура плавления | 129,03 °C |
| Температура кипения | 155 °C |
| Температура разложения | 600 °C |
| Критическая точка | 631 °C, 9,3 МПа |
| Классификация | |
| Рег. номер CAS | 13709-36-9 |
| SMILES | FXeF |
Дифторид ксенона XeF2 — твёрдое плотное кристаллическое соединение белого цвета, образованное атомами фтора и ксенона. Одно из самых устойчивых соединений ксенона.
Содержание
- 1 Физико-химические свойства
- 2 Строение
- 3 Получение
- 4 Химические свойства
- 5 Применение
- 6 Примечания
- 7 См. также
- 8 Литература
Физико-химические свойства
Обладает характерным тошнотворным запахом.
В инфракрасных спектрах наблюдается чёткий дублет полос поглощения с волновыми числами 550 и 556 см−1.
Термодинамические величины
| Свойство | Значение |
|---|---|
| Стандартная энтальпия образования (298 К, в твёрдой фазе) | −176 кДж/моль |
| Стандартная энтальпия образования (298 К, в газовой фазе) | −107,5 кДж/моль |
| Энтальпия плавления | 16,8 кДж/моль |
| Энтальпия возгонки | 50,6 кДж/моль |
| Энтропия образования (298 К, в газовой фазе) | 259,403 Дж/(моль·К) |
| Теплоёмкость (298 К, в газовой фазе) | 54,108 Дж/(моль·К) |
Растворимость
| Растворитель | Значение |
|---|---|
| Жидкий аммиак | Не растворим |
| Ацетонитрил | Растворим |
| Вода (при 0 °C) | 2,5 г/100 мл |
| Диоксид серы | Растворим |
| Пентафторид иода | 153,8 г/100 мл |
| Трифторид брома | Растворим |
| Фтороводород | Растворим |
Строение

Кристаллическая ячейка XeF2
Молекула дифторида ксенона линейная. Длины связей Xe—F равны 0,198 нм.
Получение
Впервые синтез XeF2 провёл Червик Виикс в 1962 году.
Синтез проводят из простых веществ при нагревании, ультрафиолетовом облучении или действии электрического разряда:

Продукт конденсируют при −30 °C. Очистку проводят методом фракционной дистилляции.
Механизм данной реакции достаточно интересный, и, по-видимому, в нём как-то участвуют молекулы водорода, которыми обычно загрязнён газообразный фтор. Это обнаружили Шмарк и Лютар, которые для синтеза использовали неочищенный от водорода фтор, и при этом скорость реакции выросла в 4 раза по сравнению с использованием чистого фтора.
Также существует метод получения дифторида ксенона из фторида кислорода(II) и ксенона. Для этого смесь газов помещают в никелевый сосуд и нагревают до 300 °C под давлением:

В России налажено производство дифторида ксенона на Сибирском химическом комбинате.
Дифторид ксенона образуется также при реакции ксенона с диоксидифторидом при −120 °C.
Химические свойства
При возгонке дифторид ксенона диспропорционирует на свободный ксенон и тетрафторид ксенона:

В холодной подкисленной воде разлагается достаточно медленно, зато в щелочной среде разложение идёт быстро:

Менее активный окислитель, чем молекулярный фтор.
Образование координационных соединений
XeF2 может выступать в качестве лиганда в комплексных соединениях. Например, в фтороводородном растворе возможна следующая реакция:
![\mathsf{Mg[AsF_6]_2 + 4XeF_2 \rightarrow [Mg(XeF_2)_4][AsF_6]_2}](https://dic.academic.ru/dic.nsf/ruwiki/9beae29a3877285102f8954453d82ab2.png)
Кристаллографический анализ показывает, что атом магния координирован 6 атомами фтора, 4 из которых являются мостиками между атомами магния и ксенона.
Известно множество реакций такого типа [Mx(XeF2)n](AF6)x, в которых в качестве атома M могут выступать Ca, Sr, Ba, Pb, Ag, La или Nd, а атомом A могут быть As, Sb или P.
Такие реакции требуют большого избытка дифторида ксенона.
В твердофазной системе в присутствии фторида цезия некоторые металлы (Ce, Pr, Nd, Tb, Dy, Tu) могут образовывать комплексные соединения типа Cs3[CeF7].
С пентафторидом мышьяка образуется гексафторарсенат трифтордиксенона, в котором в качестве катиона выступает молекулярный ион Xe2F3+. Также известны соединения, где катионом является Xe2+.
![\mathsf{AsF_5 + 2XeF_2 \rightarrow Xe_2F_3[AsF_6]}](https://dic.academic.ru/dic.nsf/ruwiki/12e9fda7f5f2a1b4a5233d299255893b.png)
Реакции фторирования с простыми веществами
XeF2 фторирует Mn, W, Nb, Sb, Sn, Ti, S, P, Te, Ge, Si до высших фторидов в интервале температур от −10 до +30 °C. Нагревание реакционной смеси до 50 °C приводит к взаимодействию дифторида ксенона с оксидами и солями многих металлов.
В твердофазной системе при нагревании окисляет Ce, Pr и Tb до тетрафторидов.
Реакции окисления
Водный раствор дифторида окисляет броматы до перброматов:

Окислительное фторирование
Пример окислительного фторирования для теллур-органического соединения (тут атом теллура меняет степень окисления от +4 до +6):

Восстановительное фторирование
Пример восстановительного фторирования (тут атом хрома меняет степень окисления от +6 до +5):

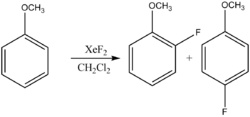
Фторирование ароматических соединений
Фторирование ароматических соединений идёт по механизму электрофильного замещения:
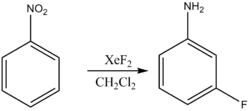
При этом возможно и восстановительное фторирование (за счет растворителя):
Фторирование непредельных соединений
Достаточно селективно можно проводить фторирование диеновых производных в 1,2-положения: 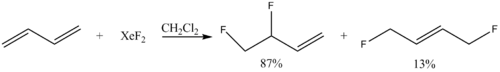 .
.
Фторирующее декарбоксилирование
Дифторид ксенона декарбоксилирует карбоновые кислоты, при этом образуются соответствующие фторалканы:

Применение
- Один из самых мощных фторирующих агентов.
- Применяют для получения высокотемпературных сверхпроводников на основе сложных слоистых оксофторидов меди[1]
- Является достаточно перспективным для дезинфекции труднодоступных мест[2]
- Дифторид ксенона используется для травления кремния в микроэлектромеханических системах:

Примечания
- ↑ Успехи химии, 2002, Том 71, Номер 5, Страницы 442—460.
- ↑ Экстремальная дезинфекция — выбор дезинфектанта
См. также
Литература
- Джолли У. И. Синтезы неорганических соединений. М.: Мир, 440 с. — 1967 г.
- Некрасов Б. В. Основы общей химии. В 2-х томах, М.:Химия, 1973 г.
- Tius, M. A., Tetrahedron, Volume 51, Issue 24, 12 June 1995, Pages 6605-6634.
- Weeks, J., Matheson, M. Xenon Difluoride. Inorganic Syntheses. № 8, 1966.
- Williamson, S. Xenon Difluoride. Inorganic Syntheses № 11, 1968.
- Šmalc,A., Lutar, K. Xenon Difluoride (Modification). Inorganic Syntheses № 29, 1992.
- D.F. Halpem. «Xenon(II) Fluoride» in Encyclopedia of Reagents for Organic Synthesis. 2004, J.Wiley & Sons, New York.
Оксид-дифторид ксенона (XeOF2) • Оксид-тетрафторид ксенона (XeOF4) • Тетраоксид ксенона (XeO4) • Триоксид ксенона (XeO3) • Фторид ксенона(II) (XeF2) • Фторид ксенона(IV) (XeF4) • Фторид ксенона(VI) (XeF6) • Гексафтороплатинат ксенона (Xe[PtF6]) • Перксенонат натрия (Na4XeO6) • Перксенат бария (Ba2XeO6) • Криптона дифторид-ксенона гексафторид (KrF2·XeF6) • Ксенона(VI) оксид-тетрафторид ванадия пентафторид (XeOF4·VF5) • Пентафтортеллуроксид ксенона (Xe(OTeF5)2) • Диоксид-дифторид ксенона (XeO2F2) • Перхлорат ксенона (Xe(ClO4)2) • Ксенонат бария (Ba3XeO6) • Перксеноновая кислота (H4XeO6) • Ксеноновая кислота (H2XeO4)