Фосфористая кислота | это... Что такое Фосфористая кислота? (original) (raw)
| Фосфористая кислота | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование | фосфоновая кислота |
| Традиционные названия | фосфористая кислота |
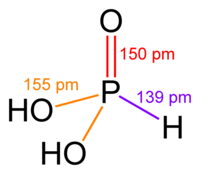
| Химическая формула | H2(PHO3) |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Отн. молек. масса | 82.00 а. е. м. |
| Молярная масса | 82.00 г/моль |
| Плотность | 1.65 г/см³ |
| Термические свойства | |
| Температура плавления | 70,1 °C |
| Температура разложения | са 100 °C |
| Химические свойства | |
| pKa | 2.0, 6.7 |
| Растворимость в воде | са 80 (20оС) |
| Классификация | |
| Рег. номер CAS | [13598-36-2] |
Фосфористая кислота, H2(PHO3), двухосновная в водных растворах, а формально трёхосновная кислота средней силы.
Свойства
Безводная фосфористая кислота – бесцветные гидроскопичные кристаллы. Фосфористая кислота является кислотой средней силы и диссоциирует по двум ступеням:
HP(O)(OH)2 → HP(O)2(OH)− + H+
HP(O)2(OH)− → HPO32− + H+
Константы диссоциации фосфористой кислоты при 18 °C: K1 = 5,1·10−2 K2 = 1,8·10−7.
При нагревании до 250 °C безводная фосфористая кислота разлагается на фосфорную кислоту и фосфин, а водные её растворы – на фосфорную кислоту и водород.

Фосфористая кислота легко окисляется галогенами, оксидами азота и пр. до фосфорной кислоты, кислородом окисляется до фосфорноватой кислоты:

Соли фосфористой ксилоты называются фосфитами или (по рекомендации ИЮПАК) фосфонаты. Большинство фосфитов мало растворимо в воде. Известны одно- и двузамещённые фосфиты.
Фосфористая кислота и её соли являются сильными восстановителями. Однако активные металлы в кислом растворе восстанавливают H3РО3 до РH3.
Эфиры фосфористой кислоты
При взаимодействии спиртов с чистым PCl3 получаются моно-, ди- и триэфиры фософористой кислоты P(OR)3, легко образующие копмлексы с переходными металлами и другими акцепторами. Они также легко окисляются до соответствующих фосфатов:
2(RO)3P + 2О2 → (RO)3PO
При взаимодействии эфиров с алкилгалогенидами образуются алкилфосфонаты:
2(RO)3P + R’X → R'(RO)2P=O + RX
Получение
Получают фосфористую кислоту растворением P4O6 (P2O3) в холодной воде, гидролизом PCl3 или взаимодействием фосфитов с серной или соляной кислотами:
P2O3 + 3 H2O → 2 H3PO3
PCl3 + 3 H2O → HP(O)(OH)2 + 3 HCl
K2HPO3 + 2 HCl → 2 KCl + H3PO3
Применение
Фосфористую кислоту и её соли применяют как восстановители.
Источники
- Карапетьянц М. Х., Дракин С.И. Общая и неорганическая химия. М.: Химия1994