Оксид цинка | это... Что такое Оксид цинка? (original) (raw)
| Оксид цинка | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование | Цинка оксид |
| Химическая формула | ZnO |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Молярная масса | 81.408 г/моль |
| Плотность | 5.61 г/см³ |
| Термические свойства | |
| Температура сублимации | 1800 °C |
| Молярная теплоёмкость (ст. усл.) | 40,28 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | 350.8 кДж/моль |
| Оптические свойства | |
| Показатель преломления | 2,015 и 2,068 |
| Структура | |
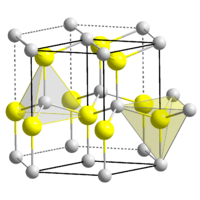
| Кристаллическая структура | гексагональная сингония, a = 0,32495 нм, c = 0,52069 нм, z = 2 |
| Классификация | |
| Рег. номер CAS | 1314-13-2 |
| Рег. номер PubChem | 14806 |
| Регистрационный номер EC | 215-222-5 |
| ChEBI | ZH4810000 |
| Безопасность | |
| ПДК | в воздухе рабочей зоны 0.5 мг/м3в атмосферном воздухе 0.05 мг/м3 |
| Токсичность | Токсичен, при вдыхании пыли вызывает литейную лихорадку |
| R-фразы | R50/53 |
| S-фразы | S60, S61 |
| NFPA 704 |  1 2 0 W 1 2 0 W |
Окси́д ци́нка (окись цинка) ZnO — бесцветный кристаллический порошок, нерастворимый в воде, желтеющий при нагревании и сублимирующийся при 1800 °C .
Свойства
- Теплопроводность: 54 Вт/(м*К)[1]
Оксид цинка является прямозонным полупроводником с шириной запрещённой зоны 3,36 эВ. Естественное легирование кислородом делает его полупроводником n-типа.
При нагревании вещество меняет цвет: белый при комнатной температуре, оксид цинка становится жёлтым. Объясняется это уменьшением ширины запрещённой зоны и сдвигом края в спектре поглощения из УФ-области в синюю.
Оксид цинка амфотерен — реагирует с кислотами с образованием солей, при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксицинкаты (Na2[Zn(OH)4], Ba2[Zn(OH)6]):
[Zn(OH)3]- + OH-  [Zn(OH)4]2-
[Zn(OH)4]2-
Оксид цинка растворяется в водном растворе аммиака, образуя комплексный аммиакат:
ZnO + 4NH3 + Н20 — [Zn(NH3)4](OH)2
При сплавлении с щелочами и оксидами металлов оксид цинка образует цинкаты:
ZnO + 2NaOH  Na2ZnO2 + H2O
Na2ZnO2 + H2O
ZnO + CoO  CoZnO2
CoZnO2
При сплавлении с оксидами бора и кремния оксид цинка образует стекловидные бораты и силикаты:
ZnO + B2O3  Zn(BO2)2
Zn(BO2)2
ZnO + SiO2  ZnSiO3
ZnSiO3
Получение
- природный минерал цинкит
- сжиганием паров цинка в кислороде («французский процесс»)
- термическим разложением соединений:
- ацетата ZnS
- гидротермальный синтез[2]
- извлечением из пылей и шламов металлургических комбинатов, особенно тех, что работают на металлоломе в качестве сырья (он содержит значительную долю оцинкованного железа).
- извлечением из тройной системы фазового равновесия «нитрат цинка-нитрат амина-вода» (с нитратом пиридина и хинолина размерность частиц порядка 5-10 нм до 75 %)
Применение
- активатор вулканизации некоторых каучуков
- вулканизирующий агент хлоропреновых каучуков
- катализатор синтеза метанола
- белый пигмент при производстве красок и эмалей (в настоящее время (2007) вытеснен нетоксичной двуокисью титана TiO2)
- наполнитель и пигмент в производстве:
* резины
* пластмасс
* бумаги
* парфюмерии и косметике - В медицине в виде присыпок и в составе мазей как антисептик. См. статью: Оксид цинка (лекарственное средство).
- добавка к кормам для животных
- в производстве стекла и красок на основе жидкого стекла
- как один из компонентов преобразователя ржавчины
Известно также, что оксид цинка обладает фотокаталитической активностью, что на практике используется для создания самоочищающихся поверхностей, бактерицидных покрытий для стен и потолков в больницах и пр. Для фотокаталитической очистки воды в промышленных масштабах оксид цинка в настоящее время не используется.
Кроме того, порошок оксида цинка — перспективный материал в качестве рабочей среды для порошковых лазеров. На основе оксида цинка создали светодиод голубого цвета. Тонкие пленки и иные наноструктуры на основе оксида цинка могут применяться как чувствительные газовые и биологические сенсоры.
Свойства оксида цинка обуславливают его широко применение в фармацевтической промышленности. Оксид цинка нашел широкое применение в создании абразивных зубных паст и цементов в терапевтической стоматологии, в кремах для загара и косметических процедурах, в производстве электрокабеля, искусственной кожи и резинотехнических изделий. Кроме того, применение распространено в шинной, лакокрасочной, нефтеперерабатывающей промышленностях. Оксид цинка участвует процессе производства стекла и керамики.
Влияние на человека
Слабо токсичен, ПДК в воздухе рабочих помещений — 6 мг/м³. Пыль может образовываться при обжиге изделий из латуни.
Примечания
- ↑ Термопрохладки
- ↑ S. Baruah and J. Dutta «Review: Hydrothermal growth of ZnO nanostructures» Sci. Technol. Adv. Mater. 10 (2009) 013001 скачать бесплатно
ПДК 2 мг/м3.
Литература
- В.И.Перельман. Краткий справочник химика. — М.-Л.: Химия, 1964.
- статья «Цинка окись» в Большой советской энциклопедии