Гематоэнцефалический барьер | это... Что такое Гематоэнцефалический барьер? (original) (raw)
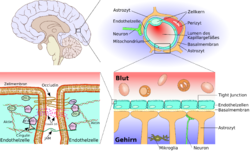
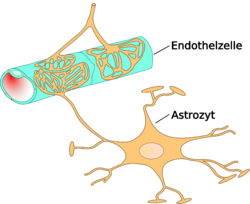
Схема строения гематоэнцефалического барьера
Гематоэнцефалический барьер (ГЭБ) (от др.-греч. αἷμα, род.п. αἷματο — «кровь» и др.-греч. εγκεφαλος — «головной мозг») — физиологический барьер между кровеносным руслом и центральной нервной системой. Имеется у всех позвоночных. Главной функцией гематоэнцефалического барьера является поддержание гомеостаза мозга.
Гематоэнцефалический барьер защищает мозг от циркулирующих в крови микроорганизмов, токсинов и различных других веществ. Он выполняет функцию высокоселективного фильтра, через который в мозг поступают питательные вещества, а из мозга выводятся продукты его жизнедеятельности.
С другой стороны наличие ГЭБ затрудняет лечение многих заболеваний, так как он не пропускает целый ряд лекарственных препаратов.
Первые исследования показавшие наличие барьера между кровью и мозгом были проведены Паулем Эрлихом в 1885 году. Окончательные доказательства существования ГЭБ были получены в 1967 году при электрономикроскопических исследованиях.
Содержание
- 1 Задачи гематоэнцефалического барьера
- 2 Строение
- 3 Гематоликворный барьер
- 4 Транспорт веществ через ГЭБ
- 5 Функции
- 6 Механизм действия
- 7 Примечания
Задачи гематоэнцефалического барьера
Масса головного мозга человека составляет приблизительно 2 % от массы его тела. При этом потребность в кислороде центральной нервной системы составляет 20 % от потребностей всего организма. Также в противоположность другим органам мозг обладает наименьшими запасами питательных веществ. Нервные клетки не могут обеспечить свои энергетические потребности анаэробно (путём одного лишь гликолиза). Прекращение поступления крови к мозгу в течение нескольких секунд приводит к потере сознания, а через 10 минут отмечается полная гибель нейронов [1]. Данная особенность головного мозга требует от ГЭБ активно транспортировать кислород и питательные вещества[2].
Нормальное функционирование мозга возможно также в условиях электролитного и биохимического гомеостаза. Колебания pH, концентрации калия крови и других показателей не должны отражаться на ткани головного мозга. Попадение циркулирующих в кровеносном русле нейромедиаторов в нервную ткань может разбалансировать её работу [1]. Также мозг должен быть защищён от попадания в него чужеродных веществ, таких как ксенобиотики и патогенные микроорганизмы. ГЭБ представляет собой в том числе и иммунологический барьер, так как является непроницаемым для различных микроорганизмов, антител и лейкоцитов[3] [4].
Чтобы обеспечить задачи обеспечения, выведения продуктов жизнедеятельности и поддержания гомеостаза вещества мозга, система сосудов центральной нервной системы имеет целый ряд структурно-функциональных отличий от сосудов других органов и тканей[1].
Изменения в функционировании ГЭБ могут вызывать нарушения функционирования центральной нервной системы. Целый ряд неврологических заболеваний напрямую или косвенно связан с его повреждением[2].
Строение
Сравнительная схема строения периферического и церебрального капилляров
нем. Periphere Kapillare — периферический капилляр
нем. Zerebrale Kapillare — церебральный капилляр
нем. Zellkern — клеточное ядро
нем. Lumen des Kapillargefäßes — просвет капиллярного сосуда
англ. Tight Junction — плотный контакт
нем. Intrazellularspalt — межклеточная щель
нем. Endothelzelle — эндотелиальная клетка
нем. Fenestrierung — фенестрация
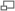
Строение ГЭБ — от ткани мозга к плотному контакту
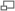
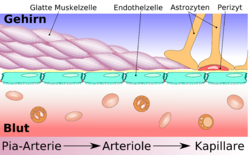
Схематическое строение сосудистой стенки артерии, артериолы и капилляра мозга
Существенным элементом структуры ГЭБ являются эндотелиальные клетки. Особенностью эндотелия сосудистой стенки церебральных сосудов является наличие между ними плотных межклеточных контактов. В структуре ГЭБ также большое значение имеют перициты и астроциты[1]. Межклеточные промежутки между эндотелиальными клетками, перицитами и астроцитами нейроглии ГЭБ являются наиболее узкими в сравнении с другими клетками организма. Эти три вида клеток являются структурной основой ГЭБ не только у человека, но и у большинства позвоночных[5] [6].
Эндотелий
Капиллярные сосуды выстланы эндотелиальными клетками. Эндотелий периферических сосудов содержит открытые промежутки (фенестрации) диаметром около 50 нм. и межклеточные щели от 0,1 до 1 мкм. Через эти пространства происходит свободная циркуляция воды и растворённых в ней веществ между кровью и межклеточным пространством. В церебральных сосудах между эндотелиальными клетками отсутствуют как фенестрации, так и межклеточные щели[7]. Таким образом можно говорить о сплошной эндотелиальной выстилке просвета капилляров мозга[8].
Другим отличием эндотелия церебральных капилляров от периферических является низкое количество в них пиноцитозных пузырьков (везикул)[9] [10].
В то же время количество митохондрий в эндотелиальных клетках сосудов мозга в 5-10 раз выше, чем в эндотелии периферических сосудов. Митохондрии являются органеллами синтезирующими молекулы АТФ, являющихся основным источником энергии для клетки. Большое количество митохондрий соответственно является показателем значительных энергетических потребностей эндотелиальных клеток ГЭБ, что связано с процессами активного транспорта и обмена веществ[4].
ГЭБ является также метаболическим или ферментативным (энзиматическим) барьером [11] [12] [13] [14] [15]. На поверхности клеточных мембран эндотелиальных клеток ГЭБ находится целый ряд ферментов в значительно большем количестве чем на других клетках паренхимы. Среди них стоит отметить гамма-глутамилтрансферазы и фосфатазы (в частности глюкоза-6-фосфатазу), катехол-О-метилтрансферазу, моноаминоксидазу и цитохром Р450[16] [17] [18]. В связи с большой концентрацией различных ферментов в эндотелиальных клетках ГЭБ многие вещества при транспортировании через цитоплазму эндотелия метаболизируются[10]. При этом по высоте эндотелиальная клетка ГЭБ составляет от 0,3 до 0,5 мкм. Энтероциты, эпителиальные клетки кишечника, к примеру имеют в высоту 17-30 мкм[19].
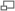
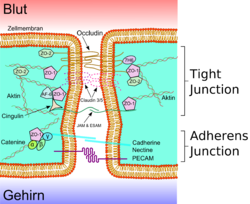
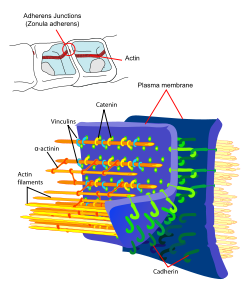
Схематическое изображение плотного контакта
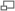
Схематическое изображение плотного контакта
Соотношение холестерина к фосфолипидам в эндотелиальных клетках ГЭБ такое же, как и в эндотелиальных клетках периферических сосудов и составляет ≈ 0,7[20]. Пассивный транспорт через клеточные мембраны ГЭБ мало чем отличается от пассивной диффузии в других эндотелиальных клетках[21]. В мембранах эндотелиальных клеток содержится большое количество каналов, которые свободно пропускают моллекулы воды. Они делают возможным свободную диффузию моллекул воды как в направлении мозга, так и кровеносной системы[22].
Отсутствие фенестраций и небольшое число пиноцитарных везикул делают эндотелиальную выстилку капилляров мозга механическим барьером для крупных молекул и инородных веществ. Кроме этого ГЭБ обладает значительным электрическим сопротивлением — около 1500—2000 Ом. К примеру электрическое сопротивление для стенок капилляров мышечной ткани составляет 30 Ом[23].
Плотные контакты
Эндотелиальные клетки плотно прилежат к другу. Между соседними клетками образуются так называемые плотные контакты. Они вносят значительный вклад в обеспечении главной функции ГЭБ — предотвращении проникновения в ткань мозга различных нежелательных веществ из кровеносного русла[24] [25]. Плотные контакты между эндотелиальными клетками блокируют межклеточный (парацеллюлярный) пассивный транспорт[26] [27] [28]. При этом блокируется парацеллюлярный транспорт веществ как из кровеносного русла в ткань мозга, так и в обратном направлении — из мозга в кровь[6].
Большое количество трансмембранных белков, таких как окклюдин, разнообразные клаудины и замыкательные адгезионные молекулы связывают латеральные отделы клеточных стенок между собой, участвуют в формировании плотных контактов и делают возможным межклеточный транспорт и обмен веществ[29]. Основными белками обеспечивающими адгезию эндотелиальных клеток и формирование плотных контактов явдяются клаудин-5 и клаудин-24 [30]. Выключение (блокирование) CLDN5—гена, ответственного за синтез белка клаудина-5, приводил у подопытных мышей к тому, что их ГЭБ становился проницаемым для молекул с молярной массой до 800 г/моль. Такие подопытные генетически изменённые животные умирали через несколько часов после рождения[31].
Базальная мембрана
Базальная мембрана эпителиальной клетки
Эндотелиальные клетки полностью покрывают подлежащий белковый слой, называемый базальной мембраной[8]. Вертикальный размер базальной мембраны колеблется от 40 до 50 нм. Она различима только под электронным микроскопом. Состоит в основном из коллагена IV типа, гепаринсульфат-протеогликанов, ламининов, фибронектина и других белков внеклеточного матрикса. Со стороны мозга базальная мембрана ограничена плазматической мембраной пластинчатых окончаний отростков астроцитов[10] [26].
Перициты
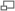
Электронномикроскопическое изображение перицита (справа) и просвета сосуда с тремя эритроцитами (слева)
Перициты, ранее называвшиеся по имени первооткрывателя Шарля Мари Бенджамина Руже (1824—1904) клетками Руже[32], являются важной составной частью ГЭБ[33]. Они обладают несколькими важными для его функционирования свойствами: способностью к сокращению, регулированию функций эндотелия и макрофагальной активностью[34].
Около 20 % поверхности эндотелиальных клеток церебральных капилляров покрыты относительно маленькими, овальными перицитами. Каждая 2—4-я эндотелиальная клетка имеет контакт с клеткой-перицитом[6]. В основном перициты располагаются в местах контакта эндотелиальных клеток[35] [36]. Перициты имеются практически во всех артериолах, венулах и капиллярах организма. Уровень покрытия ими эндотелиального слоя капилляра коррелирует с проницаемостью сосудистой стенки. В органах и тканях с проницаемой сосудистой стенкой они могут мигрировать из кровеносного русла в межклеточное пространство. Так например в капиллярах скелетной мускулатуры соотношение перициты:эндотелиоциты составляет 1:100[37] [38].
Перициты, как и эндотелиоциты располагаются на базальной мембране[8].
Также перициты синтезируют целый ряд вазоактивных веществ[38] и играют важную роль в ангиогенезе[39] [40].
Клеточные контакты перицит — эндотелиоцит
Фокальные клеточные адгезии
Перициты крепко связаны с эндотелиоцитами. Эта связь осуществляется благодаря трём типам контактов: щелевым соединениям, фокальным адгезиям и инвагинациям мембраны одной клетки в полость другой[34]. Щелевые соединения непосредственно связывают цитоплазму двух клеток, являясь проницаемыми для ионов и небольших молекул[41]. С помощью фокальных адгезий осуществляется прочная механическая связь двух типов клеток[42]. нвагинации участков цитоплазмы одной клетки в другую обеспечивают как механическое связывание так и межклеточный обмен веществ[34] [43].
Благодаря тесным контактам клетки опосредованно влияют на митотическую активность, экспрессию генов и соответственно фенотип друг друга[39].
Сократительная функция
Перициты содержат большое количество способного к сокращению белка актина. Благодаря этой своей структурной особенности они в состоянии изменять просвет капилляров и таким образом регулировать местное кровяное давление[44] [45].
Макрофагальная активность
Данное свойство характерно только для церебральных перицитов. В капиллярной сети мозга они выполняют функцию макрофагов. Соответственно в цитоплазме церебральных перицитов располагается большое количество лизосом. В культуре тканей доказана способность перицитов к фагоцитозу[34] [46] [47] и презентации антигенов [48] [49].
Астроцит (окрашен зелёным) в клеточной культуре
Макрофагальные свойства перицитов образуют «вторую линию защиты мозга» от нейротоксических молекул, которые преодолели барьер эндотелиальных клеток[50]. Таким образом они являются важной составной частью иммуной системы мозга. Сбой макрофагальной активности перицитов может стать одним из факторов развития целого ряда аутоиммунных заболеваний. Имеются данные об опосредованной роли перицитов в развитии болезни Альцгеймера[51] [52].
Астроциты
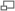
Взаимоотношение астроцитов и эндотелиоцитов
Астроциты — большие нейроглиальные клетки звёздчатой формы. Своими отростками лни выстилают стенки мозговых капилляров со стороны мозговой ткани. В то же время, несмотря на то, что пластинчатыми окончаниями их клеточных отростков выстлано около 99% капиллярных сосудов, астроциты не выполняют прямой барьерной функции[6] [53]. Астроциты тесно взаимодействуют с эндотелиальными клетками. Между ними осуществляется постоянный обмен веществ[54]. Астроглиальные клетки индуцируют возникновение и формирование ГЭБ. При проведении экспериментов по пересадке сосудов мозга в периферические органы и наоборот — периферических сосудов в ткань головного мозга, отмечено формирование ГЭБ в периферических сосудах пересаженных в мозг (образование плотных контактов, перестройка эндотелиальных клеток) и разобщение эндотелиальных клеток и появление фенестраций между ними при пересадке мозговые сосуды[1] [55]. Также in vitro показано влияние астроцитов на фенотип эндотелия. В клеточной культуре содержащей астроциты и эндотелиоциты отмечено более плотное расположение эндотелия по сравнению с его чистой клеточной культурой[56].
Астроциты выделяют целый ряд веществ, которые влияют на проницаемость эндотелия[57]. Эндотелиоциты в свою очередь выделяют ингибирующий лейкемию фактор (LIF), цитокин интерлейкин-6, которые воздействуют на процесс дифференциации астроцитов[57]. Расстояние от пластинчатых окончаний отростков астроцитов до клеток эндотелия и перицитов составляет всего лишь 20 нм[8] [58].
Главными задачами астроглиальных клеток является обеспечение нейронов питательными веществами и поддержание необходимой концентрации электролитов внеклеточного пространства[57] [59]. Астроциты синтезируют большую часть необходимого клеткам мозга холестерина. Холестерин не проникает через ГЭБ. В то же время в ткани мозга находится 25% от общего холестерина организма. Большая его часть входит в состав миелина, который окутывает отростки нейронов аксоны. Нарушения процессов миелинизации нервных волокон вызывают развитие демиелинизирующих заболеваний, в частности рассеянный склероз[60].
Пластинчатые окончания отростков астроцитов неплотно покрывают со стороны мозга базальную мембрану сосудистой стенки с расположенными на ней эндотелиоцитами и перицитами. За счёт этого между эндотелиоцитами и тканью мозга возможна прямая диффузия различных веществ[57].
Заболевания, при которых происходит прямое или опосредованное поражение астроцитов (например, болезнь Альцгеймера, астроцитомы), сопровождаются нарушением функционирования ГЭБ.
Области мозга без ГЭБ
ГЭБ имеется в капиллярах большинства, но не всех областей мозга. В 6 анатомических образованиях мозга ГЭБ отсутствует:
- Самое заднее поле (лат. area postrema) ромбовидной ямки (дна IV желудочка) — располагается между треугольником блуждающего нерва (лат. trigonum nervi vagi) с окрамляющим его самостоятельным канатиком (лат. funiculus separans) и бугорком тонкого ядра[61]
- шишковидное тело (лат. corpus pineale) (синоним — эпифиз)
- Нейрогипофиз
- Прикреплённая пластинка (лат. lamina affixa) — эмбриональный остаток стенки конечного мозга, покрывающий верхнюю поверхность таламуса. Медиально она истончается, образует извитую пластинку — сосудистую ленту (лат. tenia choroidea)[62]
- Субфорникальный орган
- Субкомиссуральный орган
Данная гистологическая особенность имеет своё обоснование. Так например, нейрогипофиз выделяет в кровь гормоны, которые не могут пройти через ГЭБ, а нейроны лат. area postrema улавливают в крови наличие токсических веществ и стимулируют рвотный центр[63]. Защитным барьером соседней с данными образованиями мозговой ткани является скопление таницитов. Они представляют собой клетки эпендимы с плотными контактами[64].
Характеристика ГЭБ
Сеть из более чем 100 миллиардов капилляров суммарной протяжённостью около 600 км пронизывает мозг взрослого человека[21]. В среднем просвет капилляра составляет около 40 нм[65]. Мозг кровоснабжается значительно сильнее многих других тканей и органов организма. Наибольшая плотность сосудов характерна для коры головного мозга — от 300 до 800 капилляров на 1 мм2 ткани[1].
Суммарная поверхность стенок сосудов мозга составляет 12[66] — 20[67] м2. Ежеминутно через сосудистую сеть мозга протекает около 610 мл крови со средней скоростью 1 мм/с. Давление в ней колеблется в пределах 15-35 мм рт. ст.[4] Среднее время прохождения крови через капиллярное русло (англ. mean transit time (MTT)) составляет всего лишь 5 секунд. Для сравнения, в кишечнике, площадь сосудов которого достигает 180 м2 оно равно 40 часам[68] [69], а в печени с 70 м2 — 30 секунд[70] [71] [72].
Развитие
До конца 20-го столетия считалось, что у эмбриона и новорожденных ГЭБ не сформирован в полной степени и соответственно не выполняет своей функции. Причиной этого, до сих пор широко распространённого мнения, являются недостатки ранее проводившихся физиологических опытов. Эксперименты заключались в введении либо связанных с белками красителей либо других маркеров взрослым животным и эмбрионам. Первые опыты такого плана проводились в 1920 году [73]. Маркеры вводимые эмбрионам проникали в ткань мозга и спинномозговую жидкость в то время как у взрослых животных — нет. В ходе данных экспериментов был допущен ряд методических ошибок (использование чрезмерного объёма вводимого вещества, повышение осмотического давления) из-за которых происходило частичное повреждение сосудистой стенки и соответственно маркер попадал в ткань мозга[74] [75] [76]. При правильной постановке экспериментов пассажа маркера через сосудистую сеть отмечено не было[77] [78] [79].
В крови плода в большом количестве содержатся молекулы таких веществ как альбумин, α1-фетопротеин и трансферрин, отсутствуя при этом в межклеточном пространстве ткани мозга[80]. В эмбриональном эндотелии обнаружен транспортёр Р-гликопротеин[81]. Это свидетельствует о наличии ГЭБ в пренатальном периоде. В ходе развития организма происходит дальнейшее совершенствование ГЭБ[80].
Для небольших поляризированных молекул, например инулина и сахарозы, проницаемость ГЭБ эмбриона и новорожденного значительно выше чем у взрослых[82] [83] [84]. Схожий эффект отмечен и для ионов[85]. Транспорт аминокислот и инсулина через ГЭБ, по всей видимости в связи с большой потребностью в них растущего мозга, значительно ускорен[86] [87] [88] [89].
С другой стороны в мозге эмбриона имеется дополнительный, отсутствующий у взрослых, барьер на границе между ликвором и тканью мозга — так называемые ремневые контакты (англ. Strap Junctions) между клетками эпендимы[90].
Эволюция
В ходе эволюции нервной ткани от беспозвоночных к позвоночным с одной стороны отмечено её увеличение и приобретение центральных функций в жизнедеятельности организмов. С другой стороны большая масса мозга требует лучшего обеспечения питательными веществами и выведения ненужных и отработанных продуктов распада. Это привело к развитию густой капиллярной сети в ткани мозга. Следующим этапом эволюции стало появление защитного барьера от циркулирующих в крови токсичных для нейронов веществ — ксенобиотиков и токсинов[5] [91].
У многих беспозвоночных ГЭБ отсутствует. У них эндотелий капилляров нервной ткани не образует сплошной выстилки сосудистой стенки. У высших беспозвоночных — насекомых, ракообразных и головоногих[92] — защитный барьер между нейронами и кровью представлен исключительно глиальной тканью[93]. В этом случае речь идёт о глиальном гематоэнцефалическом барьере[94].
У всех видов позвоночных имеется ГЭБ, и у большинства из них он образован преимущественно клетками эндотелия сосудистой стенки скреплёнными между собой плотными контактами. Только у пластиножаберных (среди них акул и скатов), а также семейства осетровых рыб ГЭБ формируется периваскулярными астроцитами. Из этого следует, что в процессе эволюции происходит увеличение количества эндотелиальных клеток сосудов головного мозга, которые перенимают на себя барьерные функции.
Структурные различия глиального и эндотелиального гематоэнцефалических барьеров достаточно велики. Эндотелиальный барьер имеет целый ряд преимуществ. Одним из них является строгое разграничение функций эндотелиальных клеток и клеток астроглии, которые обеспечивают гомеостаз внеклеточной среды вещества мозга[93].
Гематоликворный барьер
Кроме гематоэнцефалического барьера существует также гематоликворный, который ограничивает центральную нервную систему от кровеносного русла. Он образован эпителиальными клетками с плотными контактами выстилающими сосудистое сплетение желудочков мозга[95] [96]. Гематоликворный барьер также имеет свою роль в поддержании гомеостаза мозга. Через него из крови в омывающую мозг спинномозговую жидкость поступают витамины, нуклеотиды и глюкоза. Общий вклад гематоликворного барьера в процессы обмена между мозгом и кровью невелик. Суммарная площадь гематоликворного барьера сосудистых сплетений желудочков мозга приблизительно в 5000 раз меньше в сравнении с площадью гематоэнцефалического.
Кроме гематоэнцефалического и гематоликворного барьеров в организме человека существуют гематоплацентарный, гематотестикулярный, гематоклубочковый, гематоретинальный, гематотимальный и гематолёгочный барьеры.
Транспорт веществ через ГЭБ
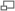
Схема транспорта различных веществ черех гематоэнцефалический барьер
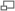
Простая диффузия через клеточную мембрану
Гематоэнцефалический барьер не только задерживает и не пропускает целый ряд веществ из крови в вещество мозга, но и выполняет противоположную функцию — транспортируют необходимые для метаболизма ткани мозга вещества. Гидрофобные вещества и пептиды проникают в мозг либо с помощью специальных транспортных систем, либо каналы клеточной мембраны. Для большинства других веществ возможна пассивная диффузия[11] [15].
Межклеточный транспорт
В капиллярах периферических органов и тканей, транспорт веществ осуществляется в основном через фенестрации сосудистой стенки и межклеточные промежутки. В норме между клетками эндотелия сосудов мозга такие промежутки отсутствуют. В связи с этим питательные вещества проникает в мозг лишь через клеточную стенку[97]. Вода, глицерин и мочевина являются примерами тех небольших поляризированных молекул, которые могут свободно диффундировать через плотные контакты между эндотелиальными клетками ГЭБ[98].
Свободная диффузия
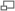
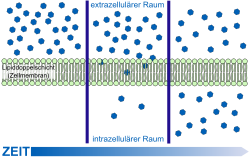
Модель пассивной диффузии через клеточную мембрану
Самой простой формой транспорта через ГЭБ является свободная (или пассивная) диффузия. Она может осуществляться как через клеточные мембраны эндотелиоцитов так и через плотные межклеточные контакты. Для диффузии веществ движущей силой является разница концентраций. Диффузия веществ пропорциональна разнице концентраций в кровяном русле и ткани мозга. Для неё не требуется затрат клеточной энергии[99].
Липофильные структурные элементы клеточной мембраны, а также плотные межклеточные контакты снижают количество веществ, которые могут свободно диффундировать через ГЭБ. Проницаемость ГЭБ напрямую зависит от липофильности каждого конкретного вещества[100].
Проницаемость ГЭБ также зависит от молярной массы вещества. Молекулы с массой более 500 г/моль не могут диффундировать через ГЭБ. В то же время ГЭБ не является механическим барьером, который свободно пропускает молекулы меньшего размера и не пропускает большего. Процесс клеточной диффузии является динамическим, при этом он легче для веществ с молярной массой 200 г/моль, чем для веществ с 450 г/моль[20] [101].
Чем липофильнее и меньше вещество, тем легче оно диффундирует через клеточную мембрану[11].
Немецким биофизиком Германном Тройбле в 1971 году была высказана гипотеза о транспорте небольших молекул через клеточную мембрану. Согласно ней они проникают в клетку через небольшие промежутки между цепями жирных кислот двойного слоя мембраны. Эти промежутки изменчивы, их образование не требует клеточной энергии[102] [103] [104] [105]. Теория Тройбле была спектроскопически доказана в 1974 году[106] [107].
Прогноз и исследования относительно проницаемости ГЭБ для того или иного вещества возможно проводить как in vitro [15] [108] [109] [101] [110] так и in silico [111].
Липофильность и небольшая молекулярная масса не являются гарантией проницаемости ГЭБ для данного вещества. Высокомолекулярные соединения (например, моноклональные антитела, рекомбинантные белки и другие) удерживаются ГЭБ[112].
Функции
- поддержание гомеостаза
- транспортная
- защитная
Механизм действия
Гематоэнцефалический барьер непроницаем для множества соединений, как чужеродных, так и вырабатываемых самим организмом.
Гематоэнцефалический барьер препятствует проникновению в центральную нервную систему переносимых кровью токсических веществ, нейромедиаторов, гормонов, антибиотиков (что затрудняет лечение инфекционных поражений мозга и его оболочек), поддерживает электролитный баланс мозга, обеспечивает избирательный транспорт ряда веществ (глюкозы, аминокислот) из крови в мозг.
Для преодоления гематоэнцефалического барьера молекулы должны быть либо малы (как молекулы кислорода), либо обладать способностью растворяться в липидных компонентах мембран глиальных клеток (как этанол). Кроме того, некоторые вещества могут переноситься через гематоэнцефалический барьер путём активного транспорта.
Примечания
- ↑ 1 2 3 4 5 6 S. Wolf, B. Seehaus, Minol K. und andere Die Blut-Hirn-Schranke: Eine Besonderheit des cerebralen Mikrozirkulationssystems // Naturwissenschaften. — 1996. — № 83. — С. 302-311.
- ↑ 1 2 S. Ohtsuki New Aspects of the Blood–Brain Barrier Transporters; Its Physiological Roles in the Central Nervous System // Biological & Pharmaceutical Bulletin. — 2004. — № 27 (10). — С. 1489–1496.
- ↑ W. Risau, B. Engelhardt, H. Wekerle Immune function of the blood-brain barrier: incomplete presentation of protein (auto-) antigens by rat brain microvascular endothelium in vitro // The Journal of Cell Biology. — 1990. — № 110. — С. 1757–1766.
- ↑ 1 2 3 B. Bauer In vitro Zellkulturmodelle der Blut-Hirn-Schranke zur Untersuchung der Permeation und P-Glykoprotein-Interaktion von Arzneistoffen // Диссертация. Гейдельбергский университет им. Рупрехта-Карла. — 2002.
- ↑ 1 2 M. Bundgaard, N. J. Abbott All vertebrates started out with a glial blood-brain barrier 4-500 million years ago // Glia. — 2008. — № 56. — С. 699–708.
- ↑ 1 2 3 4 W. M. Pardridge Molecular biology of the blood–brain barrier // Mol Biotechnol. — 2005. — № 30 (1). — С. 57–70.
- ↑ J. C. Lee Evolution in the concept of the blood-brain barrier phenomen // Progress in neuropathology. — Verlag Grune und Stratton, 1971. — Т. 1. — С. 84–145. — ISBN 0-88167-188-6
- ↑ 1 2 3 4 M. Pavelka, J. Roth Funktionelle Ultrastruktur. — Verlag Springer. — С. 234–235. — ISBN 3-211-83563-6.
- ↑ J. Cervos-Navarro Elektronenmikroskopische Befunde an den Kapillaren der Hirnrinde // Arch Psychiatr Nervenkr. — 1963. — № 204. — С. 484–504.
- ↑ 1 2 3 B. T. Hawkins, T. P. Davis The blood-brain barrier/neurovascular unit in health and disease // Pharmacol Rev. — 2005. — № 57. — С. 173–185.
- ↑ 1 2 3 S. Nobmann Isolierte Gehirn-Kapillaren als in vitro-Modell der Blut-Hirn Schranke // Диссертация. Гейдельбергский университет им. Рупрехта-Карла. — 2001.
- ↑ R. S. el-Bacha, A. Minn Drug metabolizing enzymes in cerebrovascular endothelial cells afford a metabolic protection to the brain // Cell Mol Biol. — 1999. — № 45. — С. 15–23.
- ↑ Chat M, Bayol-Denizot C, Suleman G, Roux F, Minn A. Drug metabolizing enzyme activities and superoxide formation in primary and immortalized rat brain endothelial cells // Life Sci. — 1998. — № 62. — С. 151–163.
- ↑ Minn A, Ghersi-Egea JF, Perrin R, Leininger B, Siest G. Drug metabolizing enzymes in the brain and cerebral microvessels // Life Sci. — 1991. — № 116. — С. 65–82.
- ↑ 1 2 3 Takakura Y, Audus KL, Borchardt RT. Blood-brain barrier: transport studies in isolated brain capillaries and in cultured brain endothelial cells // Adv Pharmacol. — 1991. — № 22. — С. 137–165.
- ↑ Méresse S, Dehouck MP, Delorme P, Bensaïd M, Tauber JP, Delbart C, Fruchart JC, Cecchelli R. Bovine brain endothelial cells express tight junctions and monoamine oxidase activity in long-term culture // J Neurochem. — 1989. — № 53. — С. 1363–1371.
- ↑ Perrin R, Minn A, Ghersi-Egea JF, Grassiot MC, Siest G. Distribution of cytochrome P450 activities towards alkoxyresorufin derivatives in rat brain regions, subcellular fractions and isolated cerebral microvessels // Biochem Pharmacol. — 1990. — № 40. — С. 2145–2151.
- ↑ Bendayan R, Lee G, Bendayan M. Functional expression and localization of P-glycoprotein at the blood brain barrier // Res Tech. — 2002. — № 57. — С. 365–380.
- ↑ Su Y, Sinko PJ. Drug delivery across the blood-brain barrier: why is it difficult? how to measure and improve it? // Expert Opin Drug Deliv. — 2006. — № 3. — С. 419–435.
- ↑ 1 2 Fischer H, Gottschlich R, Seelig A. Blood-brain barrier permeation: molecular parameters governing passive diffusion // J Membr Biol. — 1998. — № 165. — С. 201–211.
- ↑ 1 2 U. Fagerholm The highly permeable blood-brain barrier: an evaluation of current opinions about brain uptake capacity // J Membr Biol. — 2007. — № 12. — С. 1076–1082.
- ↑ Nico B, Frigeri A, Nicchia GP, Quondamatteo F, Herken R, Errede M, Ribatti D, Svelto M, Roncali L. Role of aquaporin-4 water channel in the development and integrity of the blood-brain barrier // J Cell Sci. — 2001. — № 114. — С. 1297–1307.
- ↑ Butt AM, Jones HC, Abbott NJ. Electrical resistance across the blood-brain barrier in anaesthetized rats: a developmental study // J Physiol. — 1990. — № 429. — С. 47-62.
- ↑ P. Claude, D. A. Goodenough Fracture faces of zonulae occludentes from "tight" and "leaky" epithelia // J Cell Biol. — 1973. — № 58. — С. 390-400.
- ↑ Wolburg H, Neuhaus J, Kniesel U, Krauss B, Schmid EM, Ocalan M, Farrell C, Risau W. Modulation of tight junction structure in blood-brain barrier endothelial cells. Effects of tissue culture, second messengers and cocultured astrocytes // J Cell Sci. — 1994. — № 107. — С. 1347–1357.
- ↑ 1 2 H. B. Newton Advances in strategies to improve drug delivery to brain tumors // Expert Rev Neurother. — 2006. — № 6. — С. 1495–1509.
- ↑ J. L. Madara Tight junction dynamics: is paracellular transport regulated? // Cell. — 1988. — № 53. — С. 497–498.
- ↑ H. C. Bauer et al. Proteins of the tight junctions in the blood-brain barrier // Blood-spinal Cord and Brain Barriers in Health and Disease. — Verlag Elsevier, 2004. — С. 1–10.
- ↑ Cecchelli R, Berezowski V, Lundquist S, Culot M, Renftel M, Dehouck MP, Fenart L. Modelling of the blood-brain barrier in drug discovery and development // Nat Rev Drug Discov. — 2007. — № 6. — С. 650–661.
- ↑ Matter K, Balda MS. Holey barrier: claudins and the regulation of brain endothelial permeability // J Cell Biol.. — 2003. — № 161. — С. 459–460.
- ↑ Nitta T, Hata M, Gotoh S, Seo Y, Sasaki H, Hashimoto N, Furuse M, Tsukita S. Size-selective loosening of the blood-brain barrier in claudin-5-deficient mice // J Cell Biol. — 2003. — № 161. — С. 653–660.
- ↑ P. Dore-Duffy Pericytes: pluripotent cells of the blood brain barrier // Curr Pharm Des. — 2008. — № 14. — С. 1581-1593.
- ↑ Balabanov R, Dore-Duffy P. Role of the CNS microvascular pericyte in the blood-brain barrier // J Neurosci Res.. — 1998. — № 53. — С. 637-644.
- ↑ 1 2 3 4 Rucker HK, Wynder HJ, Thomas WE. Cellular mechanisms of CNS pericytes // Brain Res Bull. — 2000. — № 51. — С. 363-369.
- ↑ P. A. D'Amore Culture and Study of Pericytes // Cell Culture Techniques in Heart and Vessel Research. — Verlag Springer, 1990. — С. 299. — ISBN 3-540-51934-3.
- ↑ N. J. Abbott Neurobiology. Glia and the blood-brain barrier // Nature. — 1987. — № 325. — С. 195.
- ↑ Lai CH, Kuo KH. The critical component to establish in vitro BBB model: Pericyte // Brain Res Brain Res Rev. — 2005. — № 50. — С. 258-265.
- ↑ 1 2 Shepro D, Morel NM. Pericyte physiology // FASEB. — 1993. — № 7. — С. 1031–1038.
- ↑ 1 2 Sims DE. Diversity within pericytes // Clin Exp Pharmacol Physiol. — 2000. — № 27. — С. 842–846.
- ↑ Engelhardt B. Development of the blood-brain barrier // Cell Tissue Res. — 2003. — № 314. — С. 119–129.
- ↑ Fujimoto K. Pericyte-endothelial gap junctions in developing rat cerebral capillaries: a fine structural study // Anat Rec. — 1995. — № 242. — С. 562-565.
- ↑ Díaz-Flores L, Gutiérrez R, Varela H, Rancel N, Valladares F. Microvascular pericytes: A review of their morphological and functional characteristics // Histol Histopath. — 1991. — № 6. — С. 269–286.
- ↑ D. E. Sims Recent advances in pericyte biology--implications for health and disease // Can J Cardiol. — 1991. — № 7. — С. 431–443.
- ↑ Herman IM, D'Amore PA. Microvascular pericytes contain muscle and nonmuscle actins // J Cell Biol. — 1985. — № 101. — С. 43–52.
- ↑ Hirschi KK, D'Amore PA. Pericytes in the microvasculature // Cardiovasc Res. — 1996. — № 32. — С. 687-698.
- ↑ Mato M, Ookawara S, Sugamata M, Aikawa E. Evidence for the possible function of the fluorescent granular perithelial cells in brain as scavengers of high-molecular-weight waste products // Experientia. — 1984. — № 40. — С. 399-402.
- ↑ Balabanov R, Washington R, Wagnerova J, Dore-Duffy P. CNS microvascular pericytes express macrophage-like function, cell surface integrin alphaM, and macrophage marker ED-2 // Microvasc Res. — 1996. — № 52. — С. 127-142.
- ↑ Hickey WF, Kimura H. Perivascular microglial cells of the CNS are bone marrow-derived and present antigen in vivo // Science. — 1988. — № 239. — С. 290-292.
- ↑ Fabry Z, Sandor M, Gajewski TF, Herlein JA, Waldschmidt MM, Lynch RG, Hart MN. Differential activation of Th1 and Th2 CD4+ cells by murine brain microvessel endothelial cells and smooth muscle/pericytes // J Immunol. — 1993. — № 151. — С. 38-47.
- ↑ Krause D, Kunz J, Dermietzel R. Cerebral pericytes - a second line of defense in controlling blood-brain barrier peptide metabolism // Adv Exp Med Biol. — 1993. — № 331. — С. 149-152.
- ↑ Thomas WE. Brain macrophages: on the role of pericytes and perivascular cells // Brain Res Brain Res Rev. — 1999. — № 31. — С. 42-57.
- ↑ Iadecola C. Neurovascular regulation in the normal brain and in Alzheimer's disease // Nat Rev Neurosci. — 2004. — № 5. — С. 347-360.
- ↑ Johanson CE. Permeability and vascularity of the developing brain: cerebellum vs cerebral cortex // Brain Res. — 2004. — № 190. — С. 3–16.
- ↑ Neuhaus J, Risau W, Wolburg H. Induction of blood-brain barrier characteristics in bovine brain endothelial cells by rat astroglial cells in transfilter coculture // Ann N Y Acad Sci. — 1991. — № 633. — С. 578–580.
- ↑ Stewart PA, Wiley MJ. Developing nervous tissue induces formation of blood-brain barrier characteristics in invading endothelial cells: a study using quail–chick transplantation chimeras // Dev Biol.. — 1981. — № 84. — С. 183–192.
- ↑ Raub TJ, Kuentzel SL, Sawada GA. Permeability of bovine brain microvessel endothelial cells in vitro: barrier tightening by a factor released from astroglioma cells // Exp Cell Res. — 1992. — № 199. — С. 330–340.
- ↑ 1 2 3 4 Abbott NJ. Astrocyte-endothelial interactions and blood-brain barrier permeability // J Anat.. — 2002. — № 200. — С. 629–638.
- ↑ Paulson OB, Newman EA. Does the release of potassium from astrocyte endfeet regulate cerebral blood flow? // Science. — 1987. — № 237. — С. 896-898.
- ↑ Abbott NJ, Rönnbäck L, Hansson E. Astrocyte-endothelial interactions at the blood-brain barrier // Nat Rev Neurosci. — 2006. — № 7. — С. 41–53.
- ↑ Björkhem I, Meaney S. Brain cholesterol: long secret life behind a barrier. // Arterioscler Thromb Vasc Biol. — 2004. — № 24. — С. 806-815.
- ↑ Синельников Р.Д., Синельников Я.Р. Атлас анатомии человека в 4 томах. Т.4.. — М.:: Медицина, 1996. — С. 82. — 320 с. — ISBN 5-225-02723-7
- ↑ Синельников Р.Д., Синельников Я.Р. Атлас анатомии человека в 4 томах. Т.4.. — М.:: Медицина, 1996. — С. 56. — 320 с. — ISBN 5-225-02723-7
- ↑ Duvernoy HM, Risold PY. The circumventricular organs: an atlas of comparative anatomy and vascularization // Brain Res Rev. — 2007. — № 56. — С. 119-147.
- ↑ C. Lohmann Die Blut-Hirn-Schranke in vitro: Regulation der Permeabilität durch Matrixmetalloproteasen // Диссертация. Вестфальский университет имени Вильгельма. — 2003.
- ↑ W. M. Pardridge Peptide Drug Delivery to the Brain. — Raven Press, 1991. — С. 123. — ISBN 0-88167-793-0
- ↑ Chiou WL, Barve A. Linear correlation of the fraction of oral dose absorbed of 64 drugs between humans and rats // Pharm Res. — 1998. — № 15. — С. 1792-1795.
- ↑ Goodwin JT, Clark DE. In silico predictions of blood-brain barrier penetration: considerations to "keep in mind" // J Pharmacol Exp Ther. — 2005. — № 315. — С. 477-483.
- ↑ Lindstedt L, Schaeffer PJ. Use of allometry in predicting anatomical and physiological parameters of mammals // Lab Anim. — 2002. — № 36. — С. 1-19.
- ↑ Lindstedt L, Schaeffer PJ A proposed blood circulation model for Reference Man // Health Phys. — 1995. — № 69. — С. 187-201.
- ↑ Willmann S, Schmitt W, Keldenich J, Lippert J, Dressman JB. A physiological model for the estimation of the fraction dose absorbed in humans // J Med Chem. — 2004. — № 47. — С. 4022-4031.
- ↑ Fagerholm U, Johansson M, Lennernäs H Comparison between permeability coefficients in rat and human jejunum // J Med Chem. — 1996. — № 13. — С. 1336-1342.
- ↑ Leggett RW, Williams LR. Suggested reference values for regional blood volumes in humans // Health Phys. — 1991. — № 60. — С. 139-154.
- ↑ G. B. Wislocki Experimental studies on fetal absorption. I. The vitally stained fetus // Contrib Embryol Carnegie Inst. — 1920. — № 5. — С. 45-52.
- ↑ Wakai S, Hirokawa N. Development of the blood-brain barrier to horseradish peroxidase in the chick embryo // Cell Tissue Res. — 1978. — № 195. — С. 195-203.
- ↑ Risau W, Hallmann R, Albrecht U. Differentiation-dependent expression of proteins in brain endothelium during development of the blood-brain barrier // Dev Biol.. — 1986. — № 117. — С. 537-545.
- ↑ Reynolds ML, Evans CA, Reynolds EO, Saunders NR, Durbin GM, Wigglesworth JS. Intracranial haemorrhage in the preterm sheep fetus // Early Hum Dev. — 1979. — № 3. — С. 163-186.
- ↑ L. Stern, R. Peyrot Le fonctionnement de la barrière hémato-éncephalique aux divers stades de développement chez les diverses espèces animales // Compte Rendu des Societe de Biologie (Paris). — 1927. — № 96. — С. 1124–1126.
- ↑ L. Stern et al Le fonctionnement de la barrière hémato-éncephalique aux divers stades de développement chez les diverses espèces animales // Compte Rendu Soc Biol. — 1929. — № 100. — С. 231–233.
- ↑ Saunders NR, Habgood MD, Dziegielewska KM. Barrier mechanisms in the brain, II. Immature brain // Clin Exp Pharmacol Physiol. — 1999. — № 26. — С. 85–91.
- ↑ 1 2 N. R. Saunders Development of the blood–brain barrier to macromolecules // The Fluids and Barriers of the Eye and Brain / M. B. Segal. — Verlag MacMillan. — Raven Press, 1991. — С. 128-155. — ISBN 0-8493-7707-2
- ↑ Schumacher U, Mollgård K. The multidrug-resistance P-glycoprotein (Pgp, MDR1) is an early marker of blood-brain barrier development in the microvessels of the developing human brain // Histochem Cell Biol. — 1997. — № 108. — С. 179–182.
- ↑ Dziegielewska KM, Evans CA, Malinowska DH, Møllgård K, Reynolds JM, Reynolds ML, Saunders NR. Studies of the development of brain barrier systems to lipid insoluble molecules in fetal sheep // J Physiol. — 1979. — № 292. — С. 207–231.
- ↑ Ferguson RK, Woodbury DM. Penetration of 14C-inulin and 14C-sucrose into brain, cerebrospinal fluid and skeletal muscle of developing rats // Exp Brain Res. — 1969. — № 7. — С. 181–194.
- ↑ Habgood MD, Knott GW, Dziegielewska KM, Saunders NR. The nature of the decrease in blood-cerebrospinal fluid barrier exchange during postnatal brain development in the rat // J Physiol. — 1993. — № 468. — С. 73–83.
- ↑ C. E. Johanson Ontogeny of the blood–brain barrier // Implications of the Blood–Brain Barrier and Its Manipulation / E. A. Neuwelt. — Plenum Press, 1989. — С. 157-198.
- ↑ Braun LD, Cornford EM, Oldendorf WH. Newborn rabbit blood-brain barrier is selectively permeable and differs substantially from the adult // J Neurochem. — 1980. — № 34. — С. 147–152.
- ↑ Cornford EM, Braun LD, Oldendorf WH. Developmental modulations of blood–brain barrier permeability as an indicator of changing nutritional requirements in the brain // Pediatr Res. — 1982. — № 16. — С. 324–328.
- ↑ Brenton DP, Gardiner RM. Transport of L-phenylalanine and related amino acids at the ovine blood-brain barrier // J Physiol. — 1988. — № 402. — С. 497–514.
- ↑ Frank HJ, Jankovic-Vokes T, Pardridge WM, Morris WL. Enhanced insulin binding to blood–brain barrier in vivo and to brain microvessels in vitro in newborn rabbits // Diabetes. — 1985. — № 34. — С. 728–733.
- ↑ Saunders NR, Knott GW, Dziegielewska KM. Barriers in the immature brain // Cell Mol Neurobiol. — 2000. — № 20. — С. 29–40.
- ↑ Abbott NJ, Bundgaard M Electron-dense tracer evidence for a blood-brain barrier in the cuttlefish Sepia officinalis // J Neurocytol. — 1992. — № 21. — С. 276–294.
- ↑ Abbott NJ, Pichon Y The glial blood-brain barrier of crustacea and cephalopods: a review // J Physiol (Paris). — 1982. — № 21. — С. 304–313.
- ↑ 1 2 Abbott NJ. Dynamics of CNS barriers: evolution, differentiation, and modulation // Cell Mol Neurobiol. — 2005. — № 25. — С. 5–23.
- ↑ N. J. Abbott Comparative physiology of the blood-brain barrier // Physiology and pharmacology of the bloodbrain barrier / M. W. B. Bradbury. — Springer-Verlag, 1992. — С. 371-396. — ISBN 0-387-54492-5
- ↑ N. Hettenbach Einfluss chronischer elektromagnetischer Befeldung mit Mobilfunkstrahlen (GSM und UMTS) auf die Integrität der Blut-Hirn-Schranke von Ratten // Диссертация. Мюнхенский университет Людвига-Максимилиана. — 2008.
- ↑ S. I. Rapoport Blood-brain Barrier in Physiology and Medicine. — Raven Press, 1976. — ISBN 0-89004-079-6
- ↑ M. Fromm Physiologie des Menschen // Transport in Membranen und Epithelien / R. F. Schmidt, F. Lang. — Verlag Springer. — С. 41-54. — ISBN 978-3-540-32908-4
- ↑ I. Sauer Apolipoprotein E abgeleitete Peptide als Vektoren zur Ьberwindung der Blut-Hirn-Schranke // Диссертация. Свободный университет Берлина. — 2004.
- ↑ Egleton RD, Davis TP Development of neuropeptide drugs that cross the blood-brain barrier // NeuroRx. — 2005. — № 2. — С. 44-53.
- ↑ Oldendorf WH Lipid solubility and drug penetration of the blood brain barrier // Proc Soc Exp Biol Med. — 1974. — № 147. — С. 813-815.
- ↑ 1 2 R. Kaliszan, M. Markuszewski Brain/blood distribution described by a combination of partition coefficient and molecular mass // International Journal of Pharmaceutics. — 1996. — № 145. — С. 9-16.
- ↑ Träuble H Carriers and specificity in membranes. 3. Carrier-facilitated transport. Kinks as carriers in membranes // Neurosci Res Program Bull. — 1971. — № 9. — С. 361-372.
- ↑ Träuble H Phase transitions in lipids. Possible switch processes in biological membranes // Naturwissenschaften. — 1971. — № 58. — С. 277-284.
- ↑ O. Vostowsky Chemie der Naturstoffe - Lipoproteine und Membranen // Эрлангенский университет. — 2005. — № 58. — С. 42.
- ↑ W. Hoppe, R. D. Bauer Biophysik. — Verlag Birkhäuser, 1982. — С. 447-448. — ISBN 0-387-11335-5
- ↑ Seelig A, Seelig J. The dynamic structure of fatty acyl chains in a phospholipid bilayer measured by deuterium magnetic resonance // Biochemistry. — 1974. — № 13. — С. 4839-4845.
- ↑ A. Elbert Die Permeation kleiner polarer Moleküle durch Phospholipidmodellmembranen // Диссертация. Университет Кайзерслаутерна. — 1999.
- ↑ Seelig A, Gottschlich R, Devant RM A method to determine the ability of drugs to diffuse through the blood-brain barrier // Proc Natl Acad Sci U S A. — 1994. — № 91. — С. 68-72.
- ↑ Dhopeshwarkar GA, Mead JF Uptake and transport of fatty acids into the brain and the role of the blood-brain barrier system // Adv Lipid Res. — 1973. — № 11. — С. 109-142.
- ↑ Gerebtzoff G, Seelig A In silico prediction of blood-brain barrier permeation using the calculated molecular cross-sectional area as main parameter // J Chem Inf Model. — 2006. — № 46. — С. 2638-2650.
- ↑ Seelig A, Gottschlich R, Devant RM A method to determine the ability of drugs to diffuse through the blood-brain barrier // Proc Natl Acad Sci USA. — 1994. — № 91. — С. 68-72.
- ↑ Pardridge WM The blood-brain barrier: bottleneck in brain drug development // NeuroRx. — 2005. — № 2. — С. 3-14.