elektronegativitet – Store norske leksikon (original) (raw)
Eletronegativitetsverdier for noen grunnstoffer etter Pauling (også vist i en tabell nedenfor).
Elektronegativitet er et mål for evnen et atom har til å trekke til seg et elektronpar som det har felles med et annet atom i en kjemisk binding. Elektronparet som binder to atomer sammen, vil trekkes mot det mest elektronegative atomet.
Elektronegativitetsbegrepet er et av kjemiens mest nyttige hjelpemidler til å rasjonalisere reaksjoner og bindingsforhold. Begrepet ble innført av Linus Pauling, som gav det mest elektronegative grunnstoffet, fluor, verdien 4,0. Verdien for andre grunnstoffer ble beregnet relativt til dette fra termodynamiske data.
Eksempel
Et klassisk eksempel på forskjell i elektronegativitet er vannmolekylet. Oksygen har elektronegativitet 3,5, mens hydrogen har 2,1. Dette forklarer hvorfor O–H-bindingen er polar. Siden H2O-molekylet er vinklet, blir hele molekylet polart. Det blir én dipol, med negativ pol på oksygenatomet og én positiv pol midt mellom hydrogenatomene.
Paulings elektronegativitetsverdier

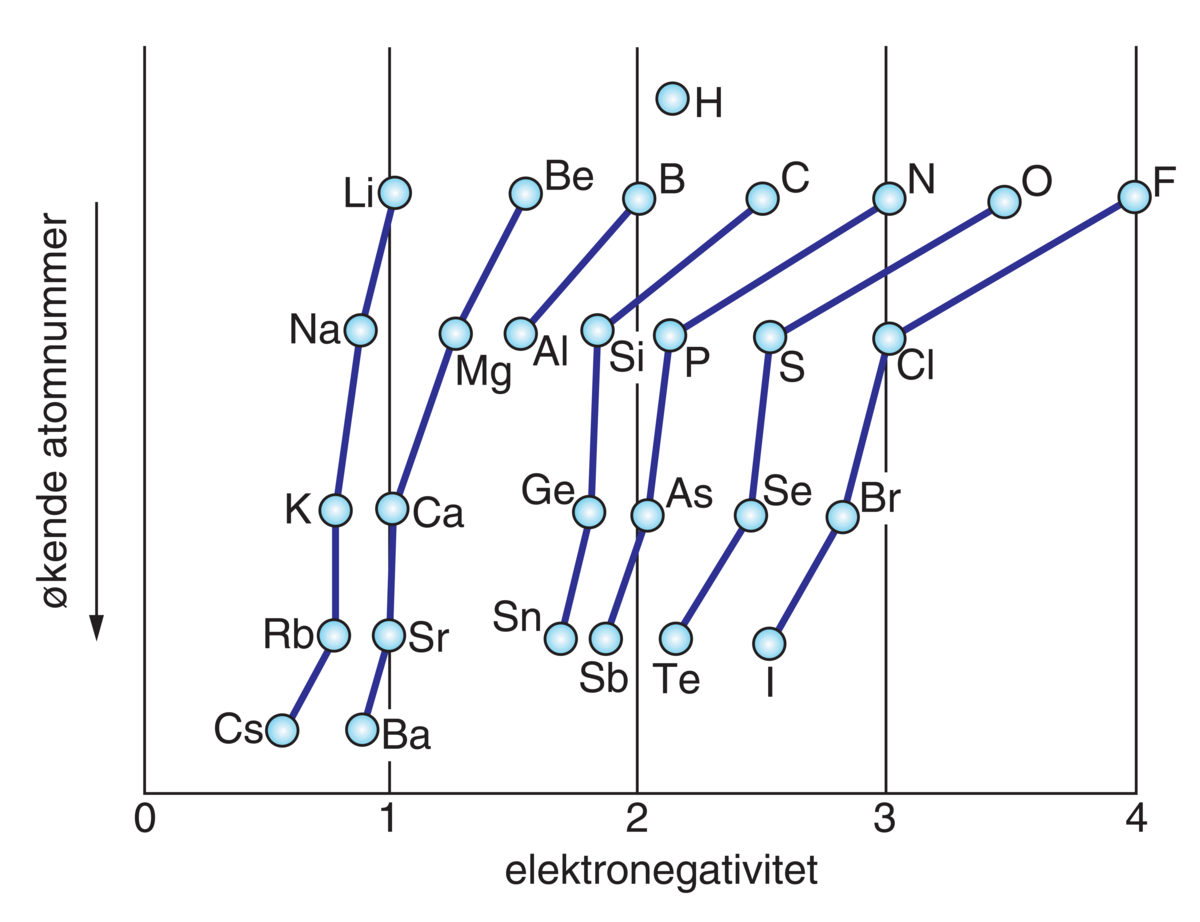
Elektronegativitetsverdier for grunnstoffene i hovedgruppene i det periodiske system.
Elektronegativiteten øker fra venstre mot høyre i grunnstoffenes periodesystem. Alkalimetallene (gruppe 1) er de minst elektronegative, og halogenene (gruppe 17) er de mest elektronegative. Elektronegativiteten avtar nedover i en gruppe, som vist i tabellen under og i figuren.
Hydrogen er vanskelig å plassere i grunnstoffenes periodesystem. Elektronegativitetsverdien for H er 2,1.
Elektronegativitetsverdiene for d -metallene ligger mellom verdien for grunnstoffet i gruppe 2 og gruppe 13 og øker stort sett fra venstre mot høyre i hver periode.
Overgang mellom bindingstypene
Forskjellen mellom elektronegativiteten til to atomer som er bundet til hverandre, sier noe om graden av ladningsforskyvning i bindingen mellom dem. Jo større forskjellen er, desto mer er elektronparet forskjøvet over mot det atomet som har størst elektronegativitet, og desto sterkere ionekarakter sier vi bindingen har.
- Er forskjellen fra 0 til 0,5, er bindingen en upolar elektronparbinding.
- Er forskjellen fra 0,5 til 1,7, er bindingen en polar binding.
- Er forskjellen større enn 1,7, er bindingen en ionebinding.
Disse reglene gjelder imidlertid ikke i alle tilfeller. Det er en polar binding mellom silisium og fluor i silisiumfluorid (SiF4), en ionebinding mellom litium og jod i litiumjodid (LiI) og en polar binding mellom karbon og brom i mange organiske bromforbindelser. Reglene forutsier imidlertid at disse bindingene er henholdsvis en ionebinding, en polar binding og en upolar elektronparbinding. En mer nøyaktig beskrivelse baserer seg på forskjell i elektronegativitet i kombinasjon med gjennomsnittlig elektronegativitet.
Metallet wolfram er hardt fordi bindingene er kovalente (elektronegativitet cirka 1,7), mens de myke alkalimetallene med elektronegativitet mellom 1,0 til 0,7 danner nesten rene metallbindinger.