oksygen (original) (raw)

Oksygen er det åttende grunnstoffet i periodesystemet. Det har atomnummer 8, atommasse 16,00 og atomsymbol O.
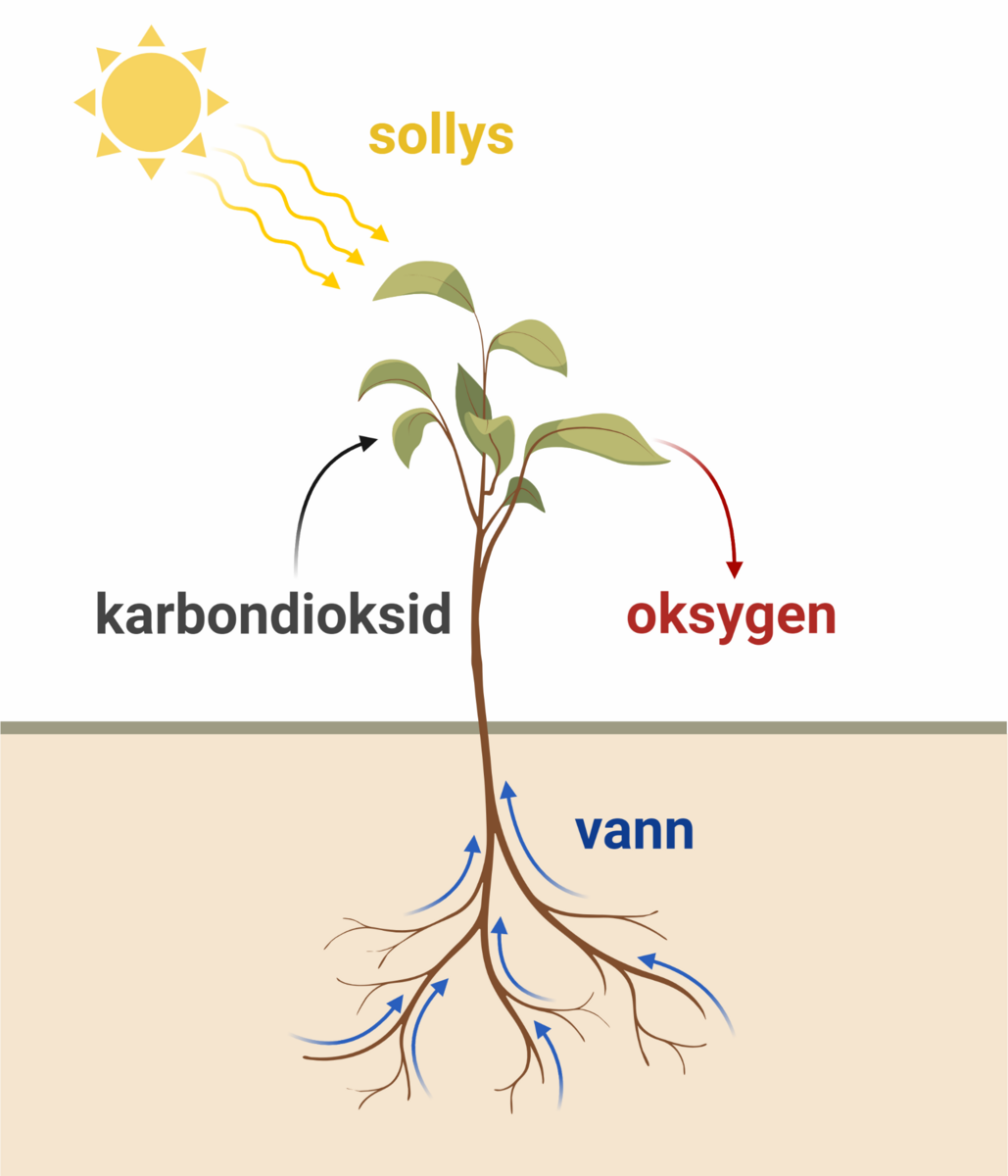
I fotosyntesen omdannes karbondioksid (CO2) og vann (H2O) til organiske stoffer som lagres i bladene og oksygen. Dette skjer ved hjelp av sollys og uorganisk mineralnæring.
Oksygen er et grunnstoff som ved romtemperatur er en fargeløs og luktfri gass. I vanlig luft er det omtrent 21 prosent oksygengass (O2). Oksygen tilhører gruppe 16 i periodesystemet.
Faktaboks
Også kjent som
tidligere kalt surstoff
Engelsk navn
oxygen
O
8
16
–218,79 °C
–182,95 °C
1,42900·10–³g/cm³
–II, –I, 0, I, II
[He]2s²2p³
Mennesker kan ikke leve uten oksygen, og oksygen er sentralt for alt liv på Jorden. Gjennom fotosyntesen bruker grønne planter karbondioksid og slipper ut oksygengass. Mennesker og dyr bruker oksygen i celleåndingen, det vil si når næringsstoffer brytes ned og frigjør energi.
- Se også oksygen – i kroppen og oksygenkretsløpet.
Oksygen er også nødvendig for alle forbrenningsprosesser. For eksempel trenger stearinlys oksygen for å brenne, og forbrenningsmotorer må ha tilgang på oksygen for å fungere.
Oksygengass kan reagere med andre stoffer, blant annet metaller. Når jern ruster, er det en reaksjon mellom jern, vann og oksygen som kalles oksidasjon.
Oksygengass består av molekyler med to oksygenatomer som er koblet sammen (kjemisk formel O2).
Forekomst

Luften vi puster inn inneholder om lag 78 prosent nitrogen og om lag 21 prosent oksygen. Mye av Jordas oksygen foreligger som vann (H2O), både i fast form og væskeform.
Oksygen er det vanligste grunnstoffet i jordskorpen. Det utgjør 49,3 masseprosent, når man regner med atmosfæren og hydrosfæren, altså all lufta og alt vannet på Jorda. Mesteparten av oksygenet i jordskorpen er bundet som mineraler, mest silikater, men også som oksider, karbonater, sulfater og annet.
Mye av Jordas oksygen foreligger som vann, både i fast form og væskeform. 86 prosent av havvannets masse skyldes oksygen, og det samme gjør cirka to tredeler (66 prosent) av menneskekroppens masse.
Tørr luft inneholder 20,95 volumprosent oksygen. Denne sammensetningen er tilnærmet konstant helt opp til en høyde på 70 kilometer. Fritt oksygen stammer for det meste fra fotosyntesen og finnes stort sett som et toatomig molekyl (O2), men kan også danne et treatomig molekyl: ozon, O3.
Oksygengass er mer løselig enn nitrogen er i vann. Derfor er luft som er løst i vann anriket på oksygengass.
Utvikling av oksygen i atmosfæren
For 3–4 milliarder år siden inneholdt atmosfæren nesten ikke noe fritt oksygen. Under disse forholdene var de første livsformene anaerobe, som betyr at de levde og utviklet seg uten oksygengass. På et tidspunkt utviklet imidlertid enkelte livsformer evnen til å bruke solenergien til å danne energirike karbohydrater fra vann og karbondioksid, med oksygen som biprodukt (se fotosyntese og fotosyntesens evolusjon). Dermed ble atmosfæren forandret, og dette førte til at mange av livsformene som fantes den gang, og som ikke tålte oksygen, døde ut eller ble fortrengt til små nisjer der de kunne unnslippe oksygenet. Det utviklet seg nye organismer som kunne leve av oksygen og karbohydrater. Etter hvert oppstod dyreliv som er helt avhengig av oksygen.
Tre milliarder år senere var atmosfærens oksygeninnhold på cirka 20 volumprosent. Med oksygen i atmosfæren ble det også dannet ozon som skjermet jordoverflaten mot den ultrafiolette strålingen fra Solen. Dermed kunne dyrelivet som til da stort sett hadde holdt til under vann for å skjerme seg mot denne strålingen, krype opp på land.
For noen hundre millioner år siden flatet økningen av oksygen i atmosfæren ut. Årsaken til dette er at selv om grønne planter og alger produserer store mengder oksygen, er dette omtrent i likevekt med det som brukes til respirasjon, forråtnelse og forbrenning. Siden det i dag ser ut til at innholdet av karbondioksid i atmosfæren øker, så peker det på at vi bruker mer oksygen enn det som blir produsert.
I kroppen

Oksygen transporteres rundt i kroppen ved hjelp av hemoglobin i de røde blodcellene.
Oksygengass er helt nødvendig for forbrenningen av energien i matvarer, slik som karbohydrater, proteiner og fett. Oksygen som vi puster inn i lungene går over i blodomløpet og fraktes i de røde blodcellene til alle cellene i kroppen (se oksygentransport i blodet).
Et voksent menneske forbruker daglig rundt 0,9 kilogram oksygengass. Mennesket kan klare seg i luft med bare 8–9 prosent oksygen, men synker innholdet til 7 prosent, blir man bevisstløs etter noe tid. Også oksygenrike blandinger kan pustes inn, men ved konsentrasjoner større enn 60 prosent oksygen kan det oppstå lungeskader ved lengre tids innånding. I medisinen pleier man å snakke om partialtrykk for oksygen i blodet. Dette kan måles med en blodprøve kalt blodgass.
- Les mer om oksygen – i kroppen
Også ozon betraktes som giftig. Siden konsentrasjonen av ozon normalt øker oppover i atmosfæren, må fly som ofte flyr i høyder på cirka 10 000 meter ha bestemte katalytiske luftfiltre for å fjerne ozon. I slike høyder er ozon til stede i store nok mengder til at det kan irritere passasjerenes lunger. I mindre konsentrasjoner kan denne irritasjonen føre til astma og lungeødem, og i større mengder kan den være dødelig.
I planter og dyr

Gjennom fotosyntesen brukes vann og karbondioksid og det lages oksygen og glukose. Dyr er avhengige av oksygenet som blir produsert gjennom fotosyntesen til det samme som menneskene bruker oksygen til.
Oksygenmengden som årlig veksler mellom atmosfæren, vannet og organismer utgjør rundt 100 milliarder tonn (1011 tonn), det vil si bare 0,01 prosent av atmosfærens totale oksygeninnhold.
- Les mer om oksygenkretsløpet
Bruk
Forbrenning

Ild oppstår når det skjer en eksoterm reaksjon mellom ved og oksygenet i lufta.
En forbrenningsreaksjon er en kjemisk reaksjon mellom oksygen og et annet stoff. Dersom reaksjonen skjer raskt, oppstår det en synlig flamme. Forbrenningsreaksjoner er eksoterme, som betyr at de frigir varme.
Mennesker har utnyttet forbrenningsreaksjoner i flere hundre tusen år, først og fremst til å lage ild. Forbrenningsmotorer er også basert på en forbrenning mellom et brennstoff og oksygenet i lufta.
I romfartøyer blir flytende oksygen brukt som oksidasjonsmiddel for fartøyets drivstoff.
Stålindustri
Innen stålindustrien brukes oksygen blant annet til å brenne vekk forurensninger som karbon, fosfor og svovel. Her går det hvert år med millioner av tonn oksygen; det kreves ett tonn oksygen for å produsere stål av ett tonn jern. Se LD-prosessen.
Kjemisk industri
Også ved kjemiske prosesser brukes oksygen, for eksempel ved oksidasjon av svoveldioksid til svoveltrioksid for fremstilling av svovelsyre, oksidasjon av ammoniakk for fremstilling av salpetersyre, fremstilling av syntesegass og generatorgass, og underjordisk gassforbrenning. Betydelige mengder oksygen brukes også til autogensveising av metaller.
Ozon (O3) er et sterkere oksidasjonsmiddel enn oksygengass (O2) og kan blant annet brukes til å desinfisere drikkevann og vann i badebassenger. Vannrensing med ozon har for eksempel vært brukt i Frankrike i mange år.
Pustehjelp

Fjellklatrere bruker ofte medbrakt oksygen ved høyder med lav oksygenmetning i atmosfæren.
Ekstra tilførsel av oksygen brukes blant annet av dykkere, klatrere og flygere, som oppholder seg i miljøer med lite eller intet oksygen.
Tidligere ga man også rent oksygen til spedbarn med pusteproblemer, men kontrollerte forsøk viste at barna hadde større sjanse for å klare seg hvis de fikk vanlig luft med rundt 20 prosent oksygen. Det reaktive oksygenet i ren form kunne skade lungene. Til voksne som trenger ekstra oksygen kan man fortsatt gi tilskuddet som ren oksygengass.
Forskning
Isotopene oksygen-17 og oksygen-18 blir brukt som sporstoffer i studier av reaksjonsmekanismer og bindingsforhold. Oksygen-18 blir også brukt ved klimatologiske og paleoklimatologiske studier. Ut fra isotopsammensetningen av oksygen i faste karbonater er det mulig å bestemme temperaturen på det tidspunktet da karbonatet ble dannet.
Forsiktighetsregler
Det er viktig å være forsiktig når man bruker oksygen i lukkede rom, fordi en økning av oksygeninnholdet med bare noen få prosent kan øke faren for antennelse av brennbare stoffer. Flytende oksygen som kommer i kontakt med varme eller brennbare stoffer kan utløse kraftige eksplosjoner.
Historikk

Antoine Lavoisier var den første som skjønte at oksygen er et grunnstoff. Etter et stikk av Brossard-Beaulieu. Tegnet mens han satt i fengsel 1793–1794.
Engelskmannen Joseph Priestley fremstilte oksygen i 1774 ved å spalte kvikksølv(II)oksid ved oppvarming. Riktignok hadde svensken Carl Wilhelm Scheele fremstilt oksygen på en lignende måte 3–5 år tidligere, men oppdagelsen ble ikke publisert før i 1776.
Den som først erkjente at oksygen er et grunnstoff og klargjorde dets rolle i forbrenningsprosessen og i forbindelse med respirasjon, var franskmannen Antoine Laurent Lavoisier i 1777. Han kalte gassen først for air vital («livsviktig luft») og senere, i 1779, oxygenium, som betyr «syredanner», fordi han antok at alle syrer inneholdt oksygen. Humphry Davy viste senere at dette ikke er riktig da han fant saltsyre, HCl.
Tilstandsformen ozon ble ikke oppdaget før i 1840 da den tyske kjemikeren Christian Friedrich Schönbein la merke til at det oppsto en eiendommelig lukt sammen med elektriske utladninger. Hans forklaring på lukten var at det ble dannet en gass som han kalte ozon, fra det greske ordet ozein som betyr «å lukte». Det tok likevel enda 25 år før den sveitsiske kjemikeren Jacques-Louis Soret (1827–1890) kunne identifisere ozonmolekylets struktur.
Fremstilling
Industrielt

Man kan fremstille hydrogen- og oksygengass ved hjelp av elektrolyse.
Industrielt fremstilles oksygen ved avkjøling og kondensasjon av luft til oksygen og nitrogen. I en nyere prosess fjernes nitrogen fra luft ved hjelp av molekylsiler som består av syntetiske zeolitter som først og fremst absorberer nitrogen. Restproduktet inneholder 95 prosent oksygen og 5 prosent argon.
Noe oksygen blir også fremstilt ved elektrolyse av vann, men da bare som biprodukt ved elektrolytisk fremstilling av hydrogen.
Markedet for industrielt fremstilt oksygen er sterkt økende. Statistikk over produsert oksygen er ikke tilgjengelig, men kan anslås til å være i størrelsesorden flere hundre millioner tonn oksygen per år.
I laboratoriet
I laboratoriet kan oksygen fremstilles ved å varme opp oksygenholdige forbindelser som lett avspalter oksygen. Et eksempel er kaliumklorat (KClO3) som i nærvær av brunstein som katalysator, spaltes til kaliumklorid og oksygen ved rundt 150 °C.
Eldre metode
En eldre kjemisk prosess for fremstilling av oksygen bestod i å la bariumoksid (BaO) reagere med luftens oksygen ved rundt 500 °C. Da ble det dannet bariumperoksid (BaO2). Ved videre oppvarming til 700 °C blir oksygen spaltet av.
Kjemiske egenskaper
Oksygen er det første grunnstoffet i gruppe 16 i periodesystemet.
Ved romtemperatur er oksygen en fargeløs gass uten lukt og smak. I væskeform og fast form, har oksygen derimot et svakt blålig skjær.
Oksygengass

Høyren, glødende oksygengass, O2.
Oksygengass består av molekyler med to oksygenatomer koblet sammen med en dobbeltbinding. Oksygenmolekylet har kjemisk formel O2.
På grunn av dobbeltbindingen er oksygenmolekylet generelt lite reaktivt ved romtemperatur, men reaksjonshastigheten øker med økende temperatur. Selv ved romtemperatur kan oksygen reagere relativt raskt med kraftige reduksjonsmidler i vann, både med metaller (som alkalimetallene) og med metallorganiske og visse uorganiske forbindelser.
Oksygenmolekylet kan spaltes i to atomer når oksygen reagerer med elektriske ladninger ved lave trykk, eller på grunn av ultrafiolett stråling fra Solen med bølgelengde mindre enn 193 nanometer. Slikt atomært oksygen er svært reaktivt.
Ozon

Molekylmodell av ozon. Alle kulene er oksygen. I virkeligheten er de to O-O-bindingene like lange og kan beskrives som en blanding av en enkeltbinding og en dobbeltbinding.
Sollys omdanner også noe oksygen i atmosfæren til ozon, som har kjemisk formel O3. Ozon er en reaktiv gass, men den beskytter livet på jordoverflaten mot skadelig ultrafiolett stråling.
Ozonmolekylet består av tre oksygenatomer i en vinklet struktur. De to ytterste oksygenatomene kommer da så nær hverandre at det blir en sterk spenning i molekylet. Dette forklarer forbindelsens ustabile karakter.
Ozon er en blå, diamagnetisk gass med en metallisk lukt som kan merkes ned til en konsentrasjon på bare 0,01 ppm. I sterkt tordenvær kan man lukte ozon i naturen. Gassen kan kondenseres til en dyp blå væske og til et sortfiolett fast stoff. Både i form av væske og fast stoff er ozon eksplosivt og må håndteres svært forsiktig.
Forbindelser

Fruktose inneholder oksygen, i likhet med alle andre karbohydrater.
Atomært oksygen (O) er et veldig reaktivt stoff som ikke kan isoleres fra andre stoffer. Oksygen danner derfor lett kjemiske forbindelser med alle grunnstoffer, også de tre tyngste edelgassene.
Uorganiske forbindelser mellom oksygen og andre grunnstoffer kalles oksider. Hva slags kjemisk binding som dannes i oksidene avhenger av grunnstoffenes plassering i periodesystemet. Oksidene til de mest elektropositive metallene (alkali- og jordalkalimetallene) har stor grad av ionebinding, mens for grunnstoffer med økende elektronegativitet dannes det i økende grad elektronparbindinger.
Oksygen er også viktig i mange organiske forbindelser, blant annet i karbohydrater, alkoholer og organiske syrer.
Som hovedregel har oksygen oksidasjonstallet –II i kjemiske forbindelser. I noen forbindelser har oksygen et formelt oksidasjonstall på –I og –½. Disse forbindelsene kalles henholdsvis peroksider og hyperoksider.
Oksygen er et av de mest elektronegative grunnstoffene – det er bare fluor som er mer elektronegativt enn oksygen. I forbindelser mellom fluor og oksygen har derfor oksygen positivt oksidasjonstall, for eksempel OF2, hvor oksygen har oksidasjonstall +II.
Tilstander av oksygen
Den laveste energitilstanden til oksygenmolekylet (grunntilstanden) er en triplett-tilstand (3O2). I grunntilstanden er oksygen paramagnetisk. Denne egenskapen forklares godt ut fra molekylorbitalteorien som viser at bindingen mellom to oksygenatomer resulterer i to uparede elektroner. Dette er unikt blant alle toatomige gasser som har et like antall elektroner.
Oksygenmolekylet kan eksiteres fra grunntilstanden (triplett, 3O2) til eksitert tilstand (singlett, 1O2) ved hjelp av lysenergi og fotosensitiserende stoffer. Singlett oksygen er ustabilt og reagerer lettere enn triplett oksygen, særlig med organiske forbindelser.
Isotoper
Det er tre stabile isotoper av oksygen:
- 16O (99,756 prosent)
- 17O (0,039 prosent)
- 18O (0,205 prosent)