ioneradius – Store norske leksikon (original) (raw)

Ioneradius for noen anioner og kationer, oppgitt i ångstrøm (1 Å = 0,1 nm). I hver rad har hvert grunnstoff og ion like mange elektroner. Radien avtar når den negative ladningen avtar eller den positive øker.
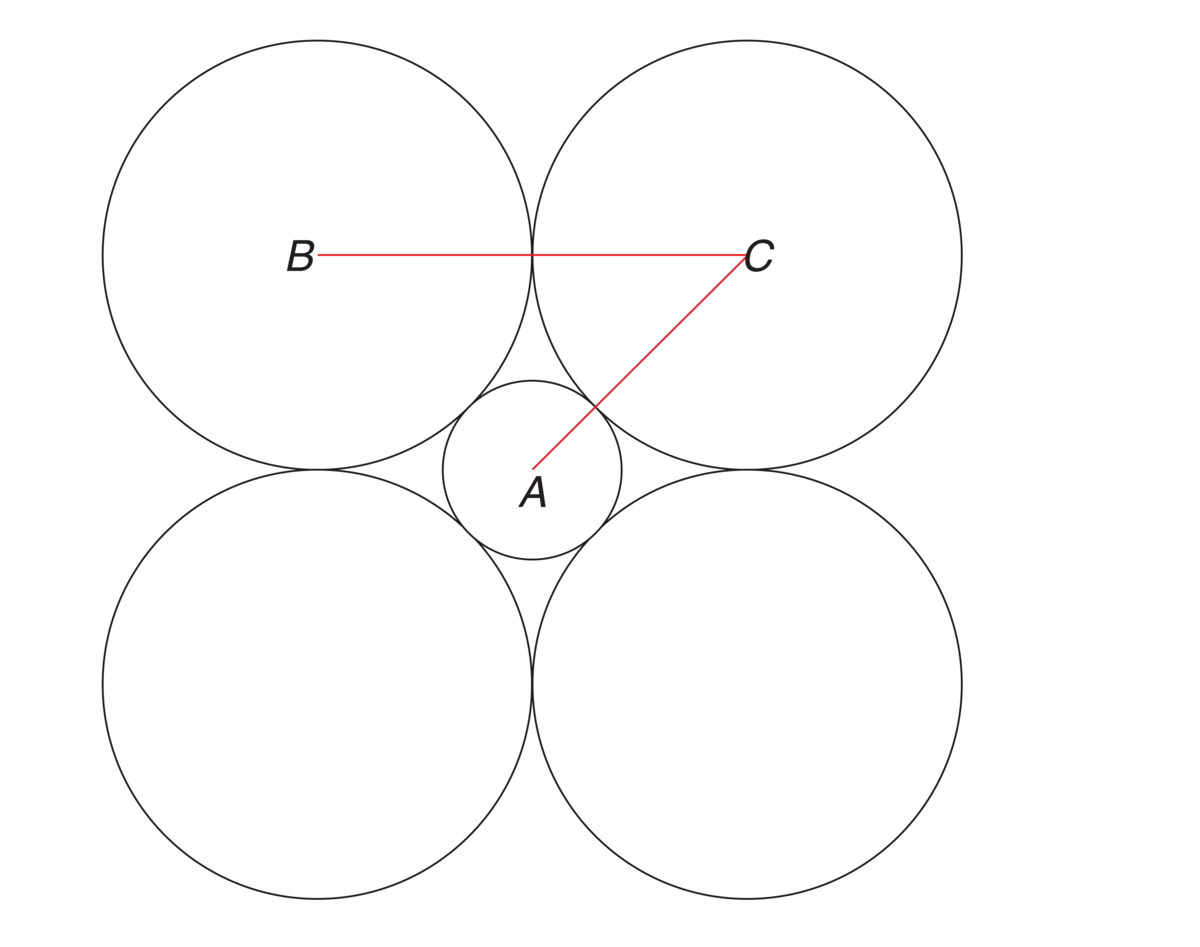
Beregning av ioneradius i en ionestruktur. A er sentrum i kationet, B og C i de to like anionene. BC er avstanden mellom anionene, og AC er avstanden mellom anion og kation. Fordi ionene er i kontakt med hverandre, vil anionets radius være BC/2 og kationets radius AC−BC/2.
Ioneradien viser størrelsen på et ion når ionet oppfattes som en kule. Denne radien blir bestemt empirisk fra krystallstrukturen av salter og andre forbindelser.
Faktaboks
Uttale
iˈoneradius
Også kjent som
ionestørrelse
I likhet med et atom har et ion en elektronsky uten skarp grense. Likevel kan begrepet ioneradius brukes for å beskrive forskjell i størrelsen til ulike ioner. Ioneradien kan beregnes ut fra avstanden mellom ioner i en ionestruktur.
Det er flere sett med ioneradier. Best kjent er de som ble bestemt av Victor Moritz Goldschmidt i 1920-årene og av Linus Pauling i 1930-årene.
Trender i ioneradien
Ioneradien avhenger av kjerneladningen og antall elektroner i ionet.
Et kation er alltid mindre enn det tilsvarende grunnstoffet, fordi kationet har færre elektroner, men samme kjerneladning. Et eksempel er ioneradien til natriumionet Na+ (102 pm), som er mindre enn atomradien til natrium (186 pm). Den store forskjellen kan forklares med elektronkonfigurasjonen til natrium og natriumionet. Det er nemlig ulikt antall elektronskall i natrium (1s2 2s2 2p6 3s1) og Na+ (1s2 2s2 2p6).
Et anion er alltid større enn det tilsvarende grunnstoffet, fordi anionet har flere elektroner, men samme kjerneladning. Et eksempel er ioneradien til oksygenionet O2− (140 pm), som er større enn atomradien til oksygen (73 pm). Ioneradien øker med antall elektronskall nedover i en gruppe i periodesystemet. Et eksempel er kationene til alkalimetallene, hvor ioneradien øker fra Li+ (76 pm) til Na+ (102 pm), K+ (138 pm), Rb+ (152 pm) og Cs+ (167 pm).
For ioner med samme elektronkonfigurasjon er det kjerneladningen som avgjør størrelsen. Jo større kjerneladningen er, desto tettere trekkes elektronene inn til kjernen, og desto mindre blir ioneradien. Et eksempel er ionerekken som er isoelektronisk med neon, hvor ioneradien avtar fra N3− (146 pm) til O2− (140 pm), F− (133 pm), Na+ (102 pm), Mg2+ (72 pm) og Al3+ (54 pm).