peroksider – Store norske leksikon (original) (raw)
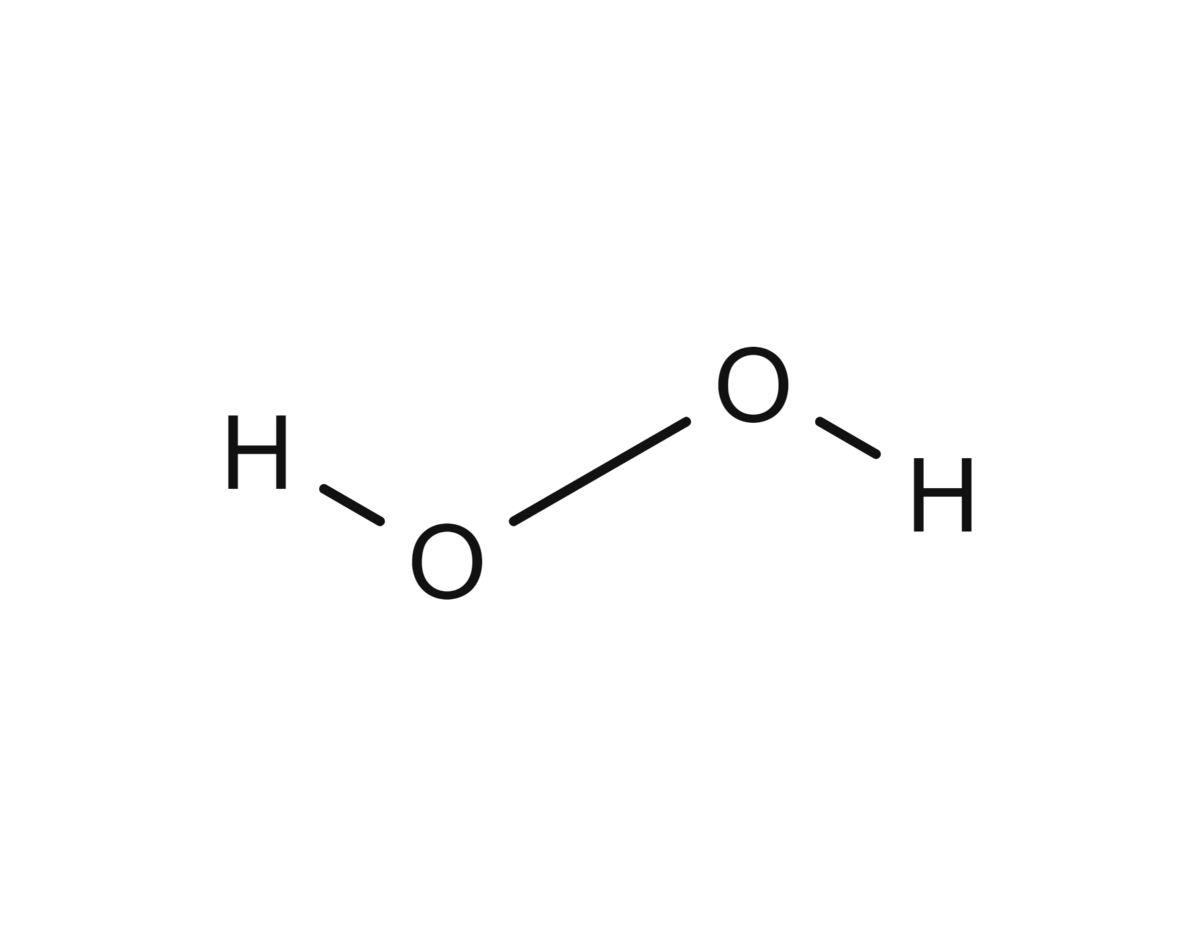
Strukturformel for hydrogenperoksid
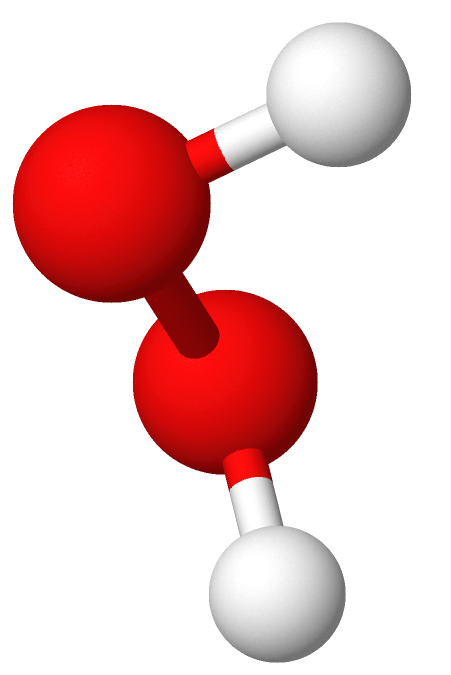
Molekylmodell av hydrogenperoksid. Hvite kuler er hydrogen og røde kuler er oksygen.
Peroksider er en gruppe kjemiske forbindelser hvor to oksygenatomer er direkte bundet til hverandre. Det finnes både uorganiske og organiske peroksider. To oksygenatomer bundet til hverandre slik som dette (–O–O–) gjør molekylet ustabilt og reaktivt.
Uorganiske peroksider
Hydrogenperoksid (H–O–O–H, H2O2) er nok det mest utbredte uorganiske peroksidet, og kan forårsake celleskade. Kroppen har imidlertid mange mekanismer for å beskytte seg mot slik skade, se antioksidanter. Hydrogenperoksid er også et mye brukt blekemiddel og til desinfeksjon. Perborater er også blant de mest kjente og brukte peroksidene.
I andre uorganiske peroksider kan oksygenatomene være negativt ladet og danner et anion med kjemisk formel O22−. Et eksempel på et uorganisk peroksid er bariumperoksid, som har kjemisk formel BaO2.
Uorganiske peroksider kan også være uorganiske salter som krystalliserer med hydrogenperoksidmolekyler (H2O2) i stedet for vannmolekyler (H2O). Et eksempel er natriumoksalatperhydrat (Na2C2O4 • H2O2).
Organiske peroksider
Organiske peroksider fremstilles ved å erstatte ett eller begge hydrogenatomene i hydrogenperoksid (H–O–O–H) med karbongrupper. Et beryktet eksempel er det ustabile triacetontriperhydrat (TATP), som er en niring av alternerende CH3–C< grupper og –O–O–-grupper. Et vanlig peroksid i organisk syntese er 3-klorperbenzosyre (MCPBA) siden dette er relativt stabilt fast stoff og enklere å håndtere enn flytende peroksider.
Oksidasjon av fettsyrer
Ved oksidasjon av fettsyrer (betaoksidasjon) dannes peroksider. Dobbeltbindinger i umettede fettsyrer brytes lett ved reaksjon med oksygen i luften (fettoksidasjon). Det skjer en oksidativ harskning når radikaler reagerer med oksygen og danner peroksider og hydrogenperoksider.
Sjansen for oksidasjon og harskning er større jo høyere innholdet av umettede fettsyrer i et fettstoff er. Prosessen påskyndes av lys, høy temperatur, oksygentilgang, lavt vanninnhold, katalysatorer som jern og kobber, enzymer og oksidasjonsprodukter. Prosessen reduseres av antioksidanter som vitamin C og vitamin E.