Нитрил | это... Что такое Нитрил? (original) (raw)
Нитри́лы, органические соединения, содержащие одну или несколько цианогрупп —C≡N, связанных с органическим радикалом. Изомерны изонитрилам 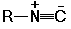 .
.
Содержание
- 1 Общие сведения
- 2 Физические свойства
- 3 Химические свойства
- 4 Способы получения
- 5 Анализ, применение и токсическое действие
- 6 См. также
- 7 Литература
- 8 Примечания
- 9 Внешние ссылки
Общие сведения
Нитрилы были впервые получены Ж. Б. А. Дюма в 1847 году [1].
Атомы С и N в цианогруппе имеют _sp_-гибридизацию; длины связей, например для СН3CN, 0,1468 нм (С—С) и 0,116 нм (C≡N); средняя энергия связи C≡N 672 кДж/моль. Обладает отрицательным индукционным и мезомерным эффектами. Названия нитрил обычно производят от названия соответствующей карбоновой кислоты, например СН3CN — ацетонитрил (нитрил уксусной кислоты), NC(CH2)4CN — адиподинитрил. Часто нитрилы рассматривают как производные синильной кислоты цианиды (например, CH2=CH-CH2-CN — аллилцианид) или цианозамещенные углеводороды (например, HC(CN)3 — трицианометан).
Физические свойства
Нитрилы — бесцветные жидкости или твердые вещества. Они плохо растворяются в воде, за исключением низших алифатических нитрилов, все хорошо растворяются в наиболее распространенных органических растворителях. В ИК спектрах нитрилов и спектрах комбинационного рассеяния присутствует характеристическая полоса валентных колебаний нитрильной группы, расположенная в диапазоне от 2220 до 2270 см-1. Величина донорного числа DN для ацетонитрила 14.1 [2].
Физические свойства некоторых важнейших нитрилов
| Соединение | Мол.вес | Тпл., °С | Ткип., °С | d204 | n20D |
|---|---|---|---|---|---|
| Акрилонитрил CH2=CHCN | 53,06 | −83,55 | 77,3 | 0,8064 | 1,3914 |
| Метакрилонитрил CH2=C(CH3)CN | −35,8 | 90,3 | 0,8001 | 1,4003 | |
| Фенилацетонитрил C6H5CH2CN | −23,8 | 107 (при 12 мм рт. ст.) | 1,018 | 1,5242 | |
| Бензонитрил C6H5CN | −12,8 | 191,1 | 1,0051 | 1,5280 | |
| Ацетилендинитрил C4N2 | 76,057 | 20,5—21 | 76,5—77 | 1,017 | |
| Пропиолонитрил С3HN | +5 | 42,5 | 0,8159 | 1,3870 | |
| Ацетонитрил CH3CN | 41,05 | −44,9 | 81,6 | 0,7828 | 1,3442 |
Химические свойства
Электронное строение нитрилов может быть представлено с помощью резонансных структур:

В соответствии с этим нитрилы вступают в реакции с электрофилами (по атому N) и нуклеофилами (по атому С). Они также образуют комплексы с солями металлов (например, CuCl, NiCl2, SbCl5, и др.) с участием неподеленной пары электронов атома N; также известны комплексы, в которых нитрилы координированы к металлоцентру так называемым "боковым" (side-on) образом за счет пи-системы данной функциональной группировки. Благодаря ненасыщенности и легкой поляризуемости цианогруппа активирует связанный с ней органический радикал, например облегчает диссоциацию связи С—Н у α-углеродного атома, а благодаря незначительному стерическому эффекту обеспечивает легкость реакций присоединения по связи C≡N.
В апротонной среде при низкой температуре нитрилы реагируют с галогеноводородами, образуя нитрилиевые соли (формула I) и соли имидоилгалогенидов (II):

1. Образование карбоновых кислот из нитрилов.
Через образование нитрилиевых солей проходит гидратация нитрилов в кислой среде до амидов и далее гидролиз до карбоновых кислот:
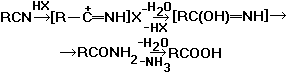
2. Получение амидов:
Амиды образуются также при гидратации нитрилов в щелочной среде (последующий гидролиз амидов приводит к солям соответствующих карбоновых кислот) и при действии на нитрилы Н2О2 (Радзишевского реакция):

3. Реакции с олефинами, реакция Дильса-Альдера (реакция циклоприсоединения).
Нитрилы реагируют с олефинами и их функциональными, производными (ненасыщенные кислоты, их эфиры и др.) в присутствии кислотного катализатора, образуя замещенные амиды (Риттера реакция); вступают в реакцию Дильса–Альдера, например:
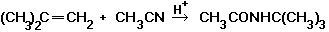

реакция Дильса–Альдера
При использовании в качестве диенофила перфторалкилцианидов RFCN или дициана реакция циклоприсоединения идет без катализатора с количественным выходом.
4. Реакция восстановления нитрилов.
Одна из важнейших реакций нитрилов — восстановление, протекающее ступенчато через промежуточное образование альдиминов:

[H] — атомарный водород в качестве востановителя в момент выделения
Для восстановления нитрилов до аминов наиболее часто применяют каталитическое гидрирование на Pt или Pd при давлении 0,1—0,3 МПа и 20—50 °С или на Ni или Со при 10—25 МПа и 100—200 °C. Для подавления образования вторичных и третичных аминов добавляют NH3. В качестве восстановителей используют также металлический Na в этаноле, комплексные гидриды металлов и бора, например LiAlH4, NaBH4 и др. При восстановлении нитрилов SnCl2 в присутствии HCl образуются соли альдиминов, гидролиз которых приводит к альдегидам (Стефена реакция):

5. Реакции по органическому радикалу.
К важнейшим реакциям нитрилов по органическому радикалу относят: взаимодействие с карбонильными соединениями с образованием цианоолефинов (Кнёвенагеля реакция), присоединение различных нуклеофилов к α,β-ненасыщенным нитрилам, например к акрилонитрилу, и полимеризацию (получение полиакрилонитрила):

Способы получения
1. Дегидратация амидов RCONH2, аммониевых солей карбоновых кислот RCOONH2 или альдоксимов RCH=NOH (перегруппировка Бекмана) при нагреве с Р2O5, PCl5, POCl3 или SOCl2. В промышленности реакцию обычно проводят в присутвии катализаторов дегидратации (Н3PO4 и ее соли) в атмосфере NH3, например:

2. Алкилирование синильной кислоты или её солей:
C2H5I + KCN →(при нагревании) C2H5CN + KI;
(CH3O)2SO2 + 2KCN → 2CH3CN + K2SO4;
Ar—SO2OCH3 + KCN → CH3CN + Ar—SO3K, где Ar— ароматический радикал.
При алкилировании алкил- и аралкилгалогенидами широко применяют межфазный катализ, например при промышленном получении бензилцианида. Ароматические нитрилы получают взаимодействием арилгалогенидов с CuCN, сплавлением солей сульфокислот с NaCN или разложением диазосоединений в присутствии CuCN, например:
Ph-Cl + CuCN → Ph-CN + CuCl;
Ar-SO3Na + NaCN → Ar-CN + Na2SO3, где Ph- фенил радикал или C6H6-
Ar-N2+Cl-+CuCN=CuCl+N2+Ar-CN
Взаимодействие ароматических углеводородов с хлорцианом в присутствиии хлорида алюминия:
3. Присоединение HCN по кратным связям (используют для получения промышленно важных нитрилов), например:
HCN + RCHO → RCH(OH)CN;
HCN + CH≡CH + Cu+ → CH2=CHCN;
HCN + CH2=CH2 (кат. Pd/Al2O3) → CH3CH2CN;
HCN + RCH=NH → RCH(NH2)CN.
Циангидрины получают присоединением HCN к карбонильным соединениям или эпоксидам в присутствии оснований.
4. Окисление углеводородов, спиртов и альдегидов. Совместное окисление углеводородов и NH3 кислородом воздуха при 400—500°С в присутствии молибдатов и фосфомолибдатов Bi, молибдатов и вольфраматов Те и Се и других катализаторов (окислительный аммонолиз): Для окисления могут быть использованы спирты в альдегиды, например:
CH2=CHCH3 + NH3 + O2 → CH2=CHCN + H2O;
Для окисления могут быть использованы спирты и альдегиды, например:
C2H5OH + NH3 + [O] → CH3CN + H2O + H2;
Нитрилы образуются также при действии окислителей на амины:
Ph-CH2NH2 (кат. NiO2; 300—350°C) → PhCN + 2H2;
5. Теломеризация олефинов с галогенцианидами или реакций последних с магнийорганическими соединениями:
_n_CH2=CH2 + ClCN → Cl(CH2CH2)_n_CN; RMgX + ClCN → RCN + MgXCl;
Анализ, применение и токсическое действие
Для анализа нитрилов используют физико-химические методы, восстановление на капельном ртутном электроде, позволяющее определять их в концентрации до 10-3—10-5%, а также химические методы, например щелочной гидролиз нитрилов с последующим, количественным определением NH3.
Применяют нитрилы в качестве растворителей, инициаторов радикально-цепной полимеризации и теломеризации, сырья в производстве волокнообразующих полимеров и смол, пластификаторов, лекарственных веществ и пестицидов. Ацетонитрил (нитрил уксусной кислоты) предложен в качестве ракетного топлива (темп.сгор. 4400 °С, уд.импульс 304 сек). Нитрил ацетилендикарбоновой кислоты (ацетилендинитрил) предложен в качестве добавки к ракетному топливу (темп.сгор. около 5000 °С в кислороде, уд. импульс около 313 сек), нитрил пропиоловой кислоты (пропиолонитрил) предложен в качестве топлива дающего большую температуру сгорания(в кислороде свыше 5000 °С).
Нитрилы ядовиты, и при работе требуют мер предосторожности (средства индивидуальной защиты, приточно-вытяжная вентиляция). Нитрилы или их отходы уничтожают щелочным гидролизом или действием окислителей (растворы Н2О2 или KMnO4). Механизм токсического действия нитрилов связан с их способностью нарушать функцию фермента цитохромоксидазы, подавляя процесс переноса кислорода из крови к клеткам организма. Отравление может произойти при вдыхании паров нитрилов, при попадания их в желудочно-кишечный тракт или через кожу. Противоядия — амилнитрит, Na2S2O3, глюкоза (как и при отравлении цианидами).
Объем производства важнейших нитрилов ~5 млн. т/год.
См. также
- Ацетонитрил
- Ацетилендинитрил
- Цианиды
- Категория:Нитрилы
Литература
- Бобков С. С., Смирнов С. К., Синильная кислота, М., 1970;
- Зильберман Е. Н., Реакции нитрилов, М., 1972;
- Общая органическая химия, пер. с англ., т. 3, М., 1982;
- Kirk-Othmer encyclopedia, 3 ed., v. 15, N.Y, 1981;
- Kukushkin V. Yu., Pombeiro A. J. L. Reactions of metal-activated nitriles, Chem. Rev., 2002, vol. 102, 1771.
- Kukushkin V. Yu., Pombeiro A. J. L. Metal-mediated and metal-catalyzed hydrolysis of nitriles (a review), Inorganica Chimica Acta, 2005, vol. 358, 1.
Примечания
- ↑ В. А. Волков, Е. В. Вонский, Г. И. Кузнецов. Выдающиеся химики мира — М.: Высшая школа, 1991. с. 159
- ↑ В. Гутман. Химия координационных соединений в неводных средах. — М.: Мир, 1971. с. 30
Внешние ссылки
| Органические вещества | |
|---|---|
| Углеводороды | Алканы · Алкены · Алкины · Диены · Циклоалканы · Арены |
| Кислородсодержащие | Спирты · Простые эфиры · Альдегиды · Кетоны · Кетены · Карбоновые кислоты · Сложные эфиры · Углеводы · Жиры · Хиноны |
| Азотсодержащие | Амины · Амиды · Нитросоединения · Нитрозосоединения · Оксимы · Нитрилы · Аминокислоты · Белки · Пептиды |
| Серосодержащие | Меркаптаны · Тиоэфиры · Сульфокислоты · Тиоальдегиды · Тиокетоны · Тиокарбоновые кислоты |
| Фосфорсодержащие | Фосфины · Фосфонистые кислоты · Фосфиновые кислоты · Фосфоновые кислоты · Нуклеиновые кислоты · Нуклеотиды |
| Кремнийорганические | Силаны · Силазаны · Силтианы · Силоксаны · Силиконы |
| Элементоорганические | Германийорганические · Борорганические · Оловоорганические · Свинецорганические · Алюминийорганические · Ртутьорганические · Другие металлоорганические |
| Другие важные классы | Галогенуглеводороды · Гетероциклические соединения · Перфторуглеводороды |
Wikimedia Foundation.2010.