Синильная кислота | это... Что такое Синильная кислота? (original) (raw)
| Синильная кислота | |
|---|---|
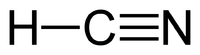 |
|
 |
|
 |
|
| Общие | |
| Традиционные названия | циановодород, синильная кислота |
| Химическая формула | HCN |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветный газ или бесцветная легколетучая жидкость |
| Молярная масса | 27,0253 г/моль |
| Плотность | 0,687 г/см³ |
| Динамическая вязкость (ст. усл.) | 0,201 Па·с(при 20 °C) |
| Термические свойства | |
| Температура плавления | −13,4 °C |
| Температура кипения | 26,7 °C |
| Температура вспышки | −17,8 °C |
| Молярная теплоёмкость (ст. усл.) | (средняя для газа и жидкости) 1,97 Дж/(моль·К) |
| Химические свойства | |
| pKa | 9,21 |
| Растворимость в воде | в любых пропорциях г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,2675 |
| Структура | |
| Дипольный момент | 2,98 Д |
| Классификация | |
| Рег. номер CAS | 74-90-8 |
| SMILES | C#N |
| Номер ООН | 1051 (безводная) |
| Регистрационный номер EC | 200-821-6 |
| RTECS | MW6825000 |
| Безопасность | |
| ЛД50 | мыши (перорально) 3.7 мг/кг |
| Токсичность |  4 4 1 4 4 1 |
Сини́льная (циа́нистоводородная) кислота́, цианистый водород, HCN[1] — бесцветная, очень летучая, легкоподвижная жидкость с характерным запахом[2].
Синильная кислота содержится в некоторых растениях, коксовом газе, табачном дыме, выделяется при термическом разложении нейлона, полиуретанов. Смешивается во всех отношениях с водой, этанолом, диэтиловым эфиром.
Содержание
- 1 Свойства
- 2 Получение
- 3 Применение
- 4 Соли
- 5 Биологические свойства
- 6 Антидоты синильной кислоты
- 7 Литература
- 8 Примечания
Свойства
Химические
Молекула HCN сильно полярна (μ = 0,96·10−29 Кл·м).
Безводный цианистый водород является сильно ионизирующим растворителем, растворенные в нем электролиты хорошо диссоциируют на ионы. Его относительная диэлектрическая проницаемость при 25 °C равна 107 (выше, чем у воды). Это обусловлено линейной ассоциацией полярных молекул HCN за счет образования водородных связей.
Очень слабая одноосновная кислота К = 1,32·10−9 (18 °C). Образует с металлами соли — цианиды. Взаимодействует с оксидами и гидроксидами щелочных и щёлочноземельных металлов.
Пары синильной кислоты горят на воздухе фиолетовым пламенем с образованием Н2О, СО2 и N2. В смеси кислорода со фтором горит с выделением большого количества тепла:
 кДж.
кДж.
Синильная кислота широко применяется в органическом синтезе. Она реагирует с карбонильными соединениями, образуя циангидрины:

С хлором, бромом и иодом прямо образует циангалогениды:

С галогеналканами — нитрилы (реакция Кольбе):

С алкенами и алкинами реагирует, присоединяясь к кратным связям:



Легко полимеризуется в присутствии основания (часто со взрывом). Образует аддукты, например HCN-CuCl.
Физиологические
Синильная кислота является веществом, вызывающим кислородное голодание тканевого типа. При этом наблюдается высокое содержание кислорода как в артериальной, так и в венозной крови и уменьшение таким образом артерио-венозной разницы, резкое понижение потребления кислорода тканями с уменьшением образования в них углекислоты. Синильная кислота и её соли, растворенные в крови, достигают тканей, где вступают во взаимодействие с трехвалентной формой железа цитохромоксидазы. Соединившись с цианидом, цитохромоксидаза утрачивает способность переносить электроны на молекулярный кислород. Вследствие выхода из строя конечного звена окисления блокируется вся дыхательная цепь и развивается тканевая гипоксия. Кислород доставляется к тканям в достаточном количестве с артериальной кровью, но ими не усваивается и переходит в неизмененном виде в венозное русло. Одновременно нарушаются процессы образования макроэргов, необходимых для нормальной деятельности различных органов и систем. Активизируется гликолиз, то есть обмен с аэробного перестраивается на анаэробный. Также подавляется активность и других ферментов — каталазы, пероксидазы, лактатдегидрогеназы.
Действие на нервную систему
В результате тканевой гипоксии, развивающейся под влиянием синильной кислоты, в первую очередь нарушаются функции центральной нервной системы.
Действие на дыхательную систему
В результате острого отравления наблюдается резко выраженное увеличение частоты и глубины дыхания. Развивающуюся одышку следует рассматривать как компенсаторную реакцию организма на гипоксию. Стимулирующее действие синильной кислоты на дыхание обусловлено возбуждением хеморецепторов каротидного синуса и непосредственным действием яда на клетки дыхательного центра. Первоначальное возбуждение дыхания по мере развития интоксикации сменяется его угнетением вплоть до полной остановки. Причинами этих нарушений являются тканевая гипоксия и истощение энергетических ресурсов в клетках каротидного синуса и в центрах продолговатого мозга.
Действие на сердечно-сосудистую систему
Проникая в кровь, она снижает способность клеток воспринимать кислород из притекающей крови. Наступает кислородное голодание[источник не указан 656 дней]. А так как нервные клетки больше всех остальных нуждаются в кислороде, они первыми страдают от действия синильной кислоты. В начальном периоде интоксикации наблюдается замедление сердечного ритма. Повышение артериального давления и увеличение минутного объема сердца происходят за счет возбуждения синильной кислотой хеморецепторов каротидного синуса и клеток сосудодвигательного центра, с одной стороны, выброса катехоламинов из надпочечников и вследствие этого спазма сосудов — с другой. По мере развития отравления артериальное давление падает, пульс учащается, развивается острая сердечно-сосудистая недостаточность и наступает остановка сердца.
Изменения в системе крови
Содержание в крови эритроцитов увеличивается, что находит объяснение в рефлекторном сокращении селезенки в ответ на развивающуюся гипоксию. Цвет венозной крови становится ярко-алым за счет избыточного содержания кислорода, не поглощенного тканями. Артерио-венозная разница по кислороду резко уменьшается. При угнетении тканевого дыхания изменяется как газовый, так и биохимический состав крови. Содержание CO2 в крови снижается вследствие меньшего образования и усиленного её выделения при гипервентиляции. Это приводит в начале развития интоксикации к газовому алкалозу, который меняется метаболическим ацидозом, что является следствием активации процессов гликолиза. В крови накапливаются недоокисленные продукты обмена. Увеличивается содержание молочной кислоты, нарастает содержание ацетоновых тел, отмечается гипергликемия. Нарушением окислительно-восстановительных процессов в тканях объясняется развитие гипотермии. Таким образом, синильная кислота и её соли вызывают явления тканевой гипоксии и связанные с ней нарушения дыхания, кровообращения, обмена веществ, функции центральной нервной системы, выраженность которых зависит от тяжести интоксикации.
Получение
В настоящий момент есть три наиболее распространенных метода получения синильной кислоты в промышленных масштабах:
- Метод Андрусова: прямой синтез из аммиака и метана в присутствии воздуха и платинового катализатора при высокой температуре:

- Метод BMA (Blausäure aus Methan und Ammoniak), запатентованный фирмой Degussa: прямой синтез из аммиака и метана в присутствии платинового катализатора при высокой температуре:

- Побочный продукт при производстве акрилонитрила путем окислительного аммонолиза пропилена.
Применение
В химическом производстве
Является сырьём для получения акрилонитрила, метилметакрилата, адипонитрила и других соединений. Синильная кислота и большое число её производных используются при извлечении благородных металлов из руд, при гальванопластическом золочении и серебрении, в производстве ароматических веществ, химических волокон, пластмасс, каучука, органического стекла, стимуляторов роста растений, гербицидов.
Как отравляющее веществo
Впервые в роли боевого отравляющего вещества синильная кислота была использована французской армией 1 июля 1916 года на реке Сомме[3]. Однако из-за отсутствия кумулятивных свойств и малой стойкости на местности последующее использование синильной кислоты в этом качестве прекратилось.
Синильная кислота являлась основной составной частью препарата «Циклон Б», который применялся нацистами во время Второй мировой войны для убийства людей в концентрационных лагерях. В некоторых штатах США синильная кислота использовалась в газовых камерах в качестве отравляющего вещества при исполнении приговоров смертной казни, в последний раз это было сделано в Аризоне в 1999 году.[4] Смерть, как правило, наступает в течение 5—15 минут.
Соли
Соли синильной кислоты называются цианидами. Цианиды подвержены сильному гидролизу. При хранении водных растворов цианидов при доступе диоксида углерода они разлагаются:
Ион CN− (изоэлектронный молекуле СО) входит как лиганд в большое число комплексных соединений d-элементов. Комплексные цианиды в растворах очень стабильны.
Цианиды тяжёлых металлов термически неустойчивы; в воде, кроме цианида ртути (Hg(CN)2), нерастворимы. При окислении цианиды образуют соли — цианаты:

Многие металлы при действии избытка цианида калия или цианида натрия дают комплексные соединения, что используется, например, для извлечения золота и серебра из руд:
![~\mathsf{4NaCN + 2Au + \frac{1}{2}O_2 + H_2O \longrightarrow 2Na[Au(CN)_2] + 2NaOH}](https://dic.academic.ru/dic.nsf/ruwiki/d55fed36ce34e67588478f17c4bcff98.png)
Биологические свойства
 |
В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.Эта отметка установлена 12 мая 2011. |
|---|
Синильная кислота — сильный яд общетоксического действия, блокирует клеточную цитохромоксидазу, в результате чего возникает выраженная тканевая гипоксия. Средние летальные дозы (LD50) и концентрации для синильной кислоты[5]:
- Мыши: ** орально (ORL-MUS LD50) — 3,7 мг/кг ** при вдыхании (IHL-MUS LD50) — 323 м.д. ** внутривенно (IVN-MUS LD50) — 1 мг/кг
- Кролики ** внутривенно (IVN-RBT LD50) < 1 мг/кг
- Человек, минимальная опубликованная смертельная доза (ORL-MAN LDLo) < 1 мг/кг
При вдыхании синильной кислоты в небольших концентрациях наблюдается царапанье в горле, горький вкус во рту, головная боль, тошнота, рвота, боли за грудиной. При нарастании интоксикации уменьшается частота пульса, усиливается одышка, развиваются судороги, наступает потеря сознания. При этом цианоз отсутствует (содержание кислорода в крови достаточное, нарушена его утилизация в тканях).
При вдыхании синильной кислоты в высоких концентрациях или при попадании её внутрь появляются клонико-тонические судороги и почти мгновенная потеря сознания вследствие паралича дыхательного центра. Смерть может наступить в течение нескольких минут.
Антидоты синильной кислоты
 |
В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.Эта отметка установлена 12 мая 2011. |
|---|
Для лечения отравлений синильной кислотой известно несколько антидотов, которые могут быть разделены на две группы. Лечебное действие одной группы антидотов основано на их взаимодействии с синильной кислотой с образованием нетоксичных продуктов. К таким препаратам относятся, например, коллоидная сера и различные политионаты, переводящие синильную кислоту в малотоксичную роданистоводородную кислоту, а также альдегиды и кетоны (глюкоза, диоксиацетон и др.), которые химически связывают синильную кислоту с образованием циангидринов. К другой группе антидотов относятся препараты, вызывающие образование в крови метгемоглобина: синильная кислота связывается метгемоглобином и не доходит до цитохромоксидазы. В качестве метгемоглобинообразователей применяют метиленовую синь, а также соли и эфиры азотистой кислоты. Одним из антагонистов синильной кислоты является сахар.
Сравнительная оценка антидотных средств: метиленовая синь предохраняет от двух смертельных доз, тиосульфат натрия и тетратиосульфат натрия — от трёх доз, нитрит натрия и этилнитрит — от четырёх доз, метиленовая синь совместно с тетратиосульфатом — от шести доз, амилнитрит совместно с тиосульфатом — от десяти доз, азотистокислый натрий совместно с тиосульфатом — от двадцати смертельных доз синильной кислоты.
Литература
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
Примечания
- ↑ Обычно под синильной кислотой в химии подразумевается водный раствор цианистого водорода, поэтому отождествление синильной кислоты с самим цианистым водородом, хотя и широко распространено, не вполне корректно.
- ↑ Кочующее из источника в источник поверье, что цианистый водород пахнет горьким миндалем, по-видимому, берет своё начало из наблюдений аптекарей, которые издавна получают слабые растворы синильной кислоты перегонкой с водяным паром амигдалинсодержащего сырья (ядер миндаля и пр.). При этом кроме цианистого водорода с водяным паром перегоняется и некоторое количество бензальдегида, который в действительности и обуславливает запах горького миндаля. Что же касается истинного запаха цианистого водорода, то он довольно неприятный («тяжелый», раздражающий) и быстро притупляется из-за паралича обонятельных нейронов.
- ↑ Сайт МСоЭС
- ↑ P.Clarke, L.Hardy, A.Williams «Executioners», London, 2008, page 493 (ISBN 978-0-70880-491-9)
- ↑ Safety (MSDS) data for hydrogen cyanide
 Боевые отравляющие вещества Боевые отравляющие вещества |
|
|---|---|
| Общеядовитого действия | Циановодород (AC) · Хлорциан (CK) · Арсин (SA) · Фосфин (PH) · Угарный газ (CO) |
| Удушающего действия | Фосген (CG) · Дифосген (DP) · Хлор (CL) |
| Кожно-нарывного действия | Иприт (HD) · Люизит (L) · Метилдихлорарсин (MD) · Этилдихлорарсин (ED) · Фенилдихлорарсин (PD) · Сесквииприт (Q) · Азотистые иприты (HN1, HN2, HN3) · Кислородный иприт (T) |
| Нервно-паралитического действия | V-агенты VE · VP · VS · VR · VM · VX · Амитон (VG) · EA 3148 G-агенты Табун (GA) · Зарин (GB) · Зоман (GD) · Циклозарин (GF) · Этилзарин (GE) · GV |
| Раздражающего действия(ирританты) | Слезоточивые вещества(лакриматоры) Хлорацетофенон (CN) · Хлорпикрин (PS) · Акролеин (DG) · Камит (CA) · Мартонит (BA) · Метилизоцианат Чихательные вещества(стерниты) Адамсит (DM) · Дифенилхлорарсин (DA) · Дифенилцианарсин (DC) Комплексные Дибензоксазепин (CR) · Хлорбензальмалондинитрил (CS) |
| Психохимического действия(инкапаситанты) | Хинуклидил-3-бензилат (BZ) · Фенциклидин (SN) · ЛСД (K) · Апоморфин · EA 3167 |
| Болевого действия (алгогены) | 1-метокси-1,3,5-циклогептатриен (CH) |
| Метаболические яды(цитотоксиканты) | 1,2-дихлорэтан · Оксид этилена · Полихлордибензодиоксины (ПХДД) · Полихлордибензофураны (ПХДФ) |


