Винилацетилен | это... Что такое Винилацетилен? (original) (raw)
| Винилацетилен | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование | Винилацетилен |
| Традиционные названия | Винилацетилен |
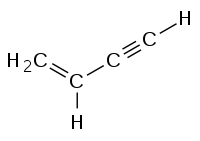
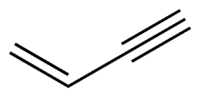
| Химическая формула | C4H4 |
| Физические свойства | |
| Молярная масса | 52,07 г/моль |
| Плотность | (при 0°С) 0,7095 г/см³ |
| Термические свойства | |
| Температура плавления | − 138 °C |
| Температура кипения | 5,01 °C |
| Молярная теплоёмкость (ст. усл.) | 73,28 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -304,6 кДж/моль |
| Классификация | |
| Рег. номер CAS | 689-97-4 |
| Рег. номер EINECS | 211-713-3 |
| SMILES | C=CC#C |
Винилацетиле́н — 1-бутен-3-ин — ненасыщенный углеводород, имеющий формулу C4H4. Содержит одну двойную и одну тройную углеродную связь.
Содержание
- 1 Физические свойства и токсичность
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 5 Литература
- 6 Примечания
Физические свойства и токсичность
Бесцветный газ с резким запахом. Не растворим в воде, растворим в углеводородах, бензоле и др. органических растворителях[1].
Раздражает слизистые оболочки, ПДК 20 мг/м³.
NFPA: 


Получение
Впервые винилацетилен был получен разложением четвертичной аммониевой соли:
[(CH3)3NCH2CH=CHCH2N(CH3)3]I2 → 2 [(CH3)3NH]I + HC≡C-CH=CH2
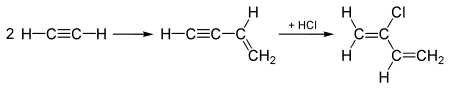
В промышленности винилацетилен получают олигомеризацией ацетилена в присутствии солей одновалентой меди и хлорида аммония в водной среде:
2H-C≡C-H → CH2=CH-C≡CH
Другой вариант — дегидрохлорирование 1,3-дихлорбутена-2 гидроксидом калия в среде этиленгликоля[1]:
CH2Cl-CH=CCl-CH3 + 2KOH → CH2=CH-C≡CH + 2KCl + 2H2O
Химические свойства
Винилацетилен в реакциях обычно ведет себя подобно ацетилену.
См. подробнее статью Алкины
Присоединяет воду в присутствии солей ртути с образованием метилвинилкетона:
CH2=CH-C≡CH + H2O → CH2=CH-CO-CH3
Образует характерный осадок при пропускании в аммиачный раствор оксида серебра:
CH2=CH-C≡CH + Ag(NH3)2OH → CH2=CH-C≡C-Ag↓ + 2NH3 + H2O
Легко гидрируется в присутствии Pd до бутадиена:
CH2=CH-C≡CH + H2 → CH2=CH-CH=CH2
Важной реакцией винилацетилена является способность присоединять HCl c образованием хлоропрена.
Применение
Реакция получения хлоропрена — мономера для синтеза хлоропреновых каучуков является одним из важнейших направлений использования винилацетилена в промышленности.
Продукты полимеризации винилацетилена находят применение в качестве лакокрасочных материалов.
Литература
- Петров А. А. Винилацетилен и его гомологи / Успехи химии, 1960, Том 29, № 9, Страницы 1049—1087.
- Вартанян С. А. Химия винилацетилена и его производных. — Ереван: Изд-во АН Арм. ССР, 1966. — 347 c.
- Темкин О. Н., Шестаков Г. К., Трегер Ю. А. Ацетилен: Химия. Механизмы реакций. Технология. — М.: Химия, 1991
Примечания
- ↑ 1 2 Химическая энциклопедия./ Винилацетилен. // Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988 год. — Т. 1.
 Углеводороды Углеводороды |
|
|---|---|
| Алканы | Метан • Этан • Пропан • Бутан • Пентан • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Гексадекан • Эйкозан ... |
| Алкены | Этилен • Пропен • Бутен • Пентен • Гексен • Гептен • Октен ... |
| Алкины | Ацетилен • Пропин • Бутин |
| Диены | Пропадиен • Бутадиен • Изопрен |
| Другие ненасыщеные | Винилацетилен • Диацетилен |
| Циклоалканы | Циклопропан • Циклобутан • Циклопентан • Циклогексан • Декалин • Индан |
| Ароматические | Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Индан • Циклобутадиен • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан |
| Полициклические | Нафталин • Антрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен |