Метан | это... Что такое Метан? (original) (raw)
| Метан | |
|---|---|
 |
|
  |
|
| Общие | |
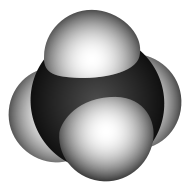
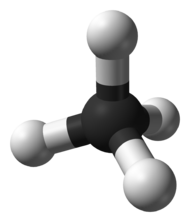
| Химическая формула | CH4 |
| Физические свойства | |
| Молярная масса | 16,04 г/моль |
| Плотность | газ (0 °C, 1013 гПа) 0,72 кг/м³;жидкость (−161,6 °C) 0,42 г/см³ |
| Термические свойства | |
| Температура плавления | -182,5 °C |
| Температура кипения | -161,6 °C |
| Химические свойства | |
| Растворимость в воде | 0,35[1] г/100 мл |
| Классификация | |
| Рег. номер CAS | 74-82-8 |
| SMILES | C |
| Безопасность | |
| Токсичность |  4 1 0 4 1 0 |
У этого термина существуют и другие значения, см. Метан (значения).
Мета́н (лат. Methanum) — простейший углеводород, бесцветный газ (в нормальных условиях) без запаха[2], химическая формула — CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно меркаптаны) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека[3]. Однако имеются данные, что метан относится к токсическим веществам, действующим на центральную нервную систему[4]. Накапливаясь в закрытом помещении, метан взрывоопасен. Обогащение одорантами делается для того, чтобы человек вовремя заметил утечку газа. На промышленных производствах эту роль выполняют датчики и во многих случаях метан для лабораторий и промышленных производств остается без запаха.
Метан — первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям. Подобно другим алканам вступает в реакции радикального замещения (галогенирования, сульфохлорирования, сульфоокисления, нитрования и др.), но обладает меньшей реакционной способностью. Специфична для метана реакция с парами воды, которая протекает на Ni/Al2O3 при 800—900 °C или без катализатора при 1400—1600 °C; образующийся синтез-газ может быть использован для синтеза метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов.
Взрывоопасен при концентрации в воздухе от 4,4 % до 17 %[5]. Наиболее взрывоопасная концентрация 9,5 %. Является наркотиком; действие ослабляется ничтожной растворимостью в воде и крови. Класс опасности — четвёртый[6].
Содержание
- 1 Источники
- 2 Получение
- 3 Химические свойства
- 4 Соединения включения
- 5 Применение метана
- 6 Физиологическое действие
- 7 Метан и экология
- 8 Ссылки
- 9 Примечания
Источники
Основной компонент природных (77—99 %), попутных нефтяных (31—90 %), рудничного и болотного газов (отсюда другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, рубце жвачных животных) образуется биогенно. Получается также при коксовании каменного угля, гидрировании угля, гидрогенолизе углеводородов в реакциях каталитического риформинга.
Классификация по происхождению:
- абиогенный — образован как результат химических реакций неорганических соединений;
- биогенный — образован как результат химической трансформации органического вещества;
- бактериальный (микробный) — образован в результате жизнедеятельности бактерий;
- термогенный — образован в ходе термохимических процессов.
Предположительно, что на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано[источник не указан 27 дней]-этановой смеси.
Получение
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и кальция) или безводного гидроксида натрия с ледяной уксусной кислотой.
![\mathsf{2NaOH + CH_3COOH \xrightarrow[]{^ot} Na_2CO_3 + CH_4\uparrow}](https://dic.academic.ru/dic.nsf/ruwiki/bcae9a4124f50c5773de5a35119055ef.png)
Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
Возможно получение метана сплавлением ацетата натрия с гидроксидом натрия[7]:

Также для лабораторного получения метана используют гидролиз карбида алюминия или некоторых металлорганических соединений (например, метилмагнийбромида).
Химические свойства
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 39 МДж на 1 м³. С воздухом образует взрывоопасные смеси при объёмных концентрациях от 5 до 15 процентов. Точка замерзания −184oС (при нормальном давлении)
Вступает с галогенами в реакции замещения, которые проходят по свободно радикальному механизму:




Выше 1400 °C разлагается по реакции:

Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:
![\mathsf{CH_4 + 3[O] \rightarrow HCOOH + H_2O}](https://dic.academic.ru/dic.nsf/ruwiki/b9197a58ace7166a10fcfc978f341774.png)
Соединения включения
Метан образует соединения включения — газовые гидраты, широко распространенные в природе.
Применение метана
- Топливо.
- Сырьё в органическом синтезе.
Физиологическое действие
Метан является самым физиологически безвредным газом в гомологическом ряду парафиновых углеводородов. Физиологическое действие метан не оказывает и не ядовит (из-за малой растворимости метана в воде и плазме крови и присущей парафинам химической инертности). Погибнуть человеку в воздухе, с высокой концентрацией метана можно только от недостатка кислорода в воздухе для дыхания при очень высоких концентрациях метана. Так, при содержании в воздухе 25—30 % метана появляются первые признаки асфиксии (учащение пульса, увеличение объёма дыхания, нарушение координации тонких мышечных движений и т. д.). Более высокие концентрации метана в воздухе вызывают у человека кислородное голодание — головную боль, одышку, — симптомы, сходные с горной болезнью.
Так как метан легче воздуха, он не скапливается в проветриваемых подземных сооружениях. Поэтому весьма редки случаи гибели людей от вдыхания смеси метана с воздухом, от асфиксии.
Первая помощь при тяжелой асфиксии: удаление пострадавшего из вредной атмосферы. При отсутствии дыхания немедленно (до прихода врача) искусственное дыхание изо рта в рот. При отсутствии пульса — непрямой массаж сердца.
Хроническое действие метана
У людей, работающих в шахтах или на производствах, где в воздухе присутствуют в незначительных количествах метан и другие газообразные парафиновые углеводороды, описаны заметные сдвиги со стороны вегетативной нервной системы (положительный глазо-сердечный рефлекс, резко выраженная атропиновая проба, гипотония) из-за весьма слабого наркотического действия этих веществ, сходного с наркотическим действием диэтилового эфира.
Метан и экология
Является парниковым газом, в этом отношении, более сильным, чем углекислый газ, из-за наличия глубоких вращательных полос поглощения его молекул в инфракрасном спектре. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность метана составит 21 единицу[8].
ПДК метана в воздухе рабочей зоны составляет 7000 мг/м3[9].
Ссылки
Примечания
- ↑ Обзор: Растворимость некоторых газов в воде
- ↑ Статья «Метан» на сайте «Химик»
- ↑ З. Гауптман, Ю. Грефе, Х. Ремане «Органическая химия», М. «Химия», 1979, стр. 203.
- ↑ Куценко С. А. Основы токсикологии / С.А. Куценко. — СПб.: Фолиант, 2004.
- ↑ ГОСТ Р 52136-2003
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, н-бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ Б. А. Павлов, А. П. Терентьев. Курс органической химии. — Издание шестое, стереотипное. — M.: Химия, 1967. — С. 58.
- ↑ EBRD Methodology for Assessment of Greenhouse Gas Emissions, Version 3 February 2009 (англ.)
- ↑ Гигиенические нормативы ГН 2.2.5.1313-03 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны»
 Углеводороды Углеводороды |
|
|---|---|
| Алканы | Метан • Этан • Пропан • Бутан • Пентан • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Гексадекан • Эйкозан ... |
| Алкены | Этилен • Пропен • Бутен • Пентен • Гексен • Гептен • Октен ... |
| Алкины | Ацетилен • Пропин • Бутин |
| Диены | Пропадиен • Бутадиен • Изопрен |
| Другие ненасыщеные | Винилацетилен • Диацетилен |
| Циклоалканы | Циклопропан • Циклобутан • Циклопентан • Циклогексан • Декалин • Индан |
| Ароматические | Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Индан • Циклобутадиен • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан |
| Полициклические | Нафталин • Антрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен |