Циан (вещество) | это... Что такое Циан (вещество)? (original) (raw)
| Циан | |
|---|---|
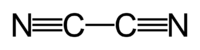 |
|
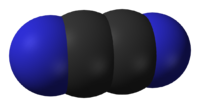 |
|
 |
|
| Общие | |
| Систематическое наименование | циан |
| Химическая формула | C2N2 |
| Физические свойства | |
| Состояние (ст. усл.) | газ |
| Отн. молек. масса | 52,04 а. е. м. |
| Молярная масса | 52,04 г·моль−1 г/моль |
| Плотность | 0,95 г·см−3 (жидкость, −21 °C)2,38 г·л−1 (газ, 0 °C, 1013 mbar) г/см³ |
| Термические свойства | |
| Температура плавления | −28 °C |
| Температура кипения | −21 °C |
| Давление пара | 0,49 MPa (20 °C) |
У этого термина существуют и другие значения, см. Циан.
Циан, дициан, (CN)2 — динитрил щавелевой кислоты, бесцветный газ с резким запахом; tпл −27,8 °C; tкип −21,15 °C; ограниченно растворим в воде, лучше — в спирте, эфире, уксусной кислоте.
Химические свойства
При длительном нагревании (400 °C) превращается в аморфный полимер — парациан (CN)x: (х = 2000-3000), который при 800 °C полностью деполимеризуется. Для циана характерны т. н. псевдогалогенные свойства: подобно галогенам (хлор, бром) он взаимодействует с водными растворами щелочей:

Имеет характерный запах миндаля.
Получение
Получают в промышленности каталитическим окислением синильной кислоты: 1) С кислородом в присутствии серебрянного катализатора [1]:

- С хлором на активированном угле [1]:

- С диоксидом азота [1]:

В лаборатории получают окислением цианидов двухвалентной медью Cu(II) в водных растворах [1]:

взаимодействием раскалённого кокса с азотом, дегидратацией диамина щавелевой кислоты (CONH2)2 и др. способами. Образуется при пиролизе азотсодержащих органических соединений и поэтому в малых количествах содержится в коксовом и доменном газах.
Нахождение в природе
Циан спектроскопически обнаружен в кометах, обнаружен в атмосфере Титана.
Применение
Используется в органическом синтезе (получение оксамида) и сваривании металлов.
В 1824 году немецкий химик Фридрих Вёлер получил из дициана и воды щавелевую кислоту.
Безопасность
- Ядовит, но по токсичности уступает синильной кислоте (фактор от 2 до 10) и её солям — цианидам. Граница восприятия человеком характерного запаха "миндаля" лежит значительно выше чем у синильной кислоты, тем не менее циан является очень опасным газом. В начале происходит резорбирование циана организмом и последующий распад С-С связи. Механизм его токсического действия похож на механизм действия синильной кислоты: блокада трехвалентного железа в системе клеточного дыхания (Цитохром с-оксидазы) и как следствие "удушие" на клеточном уровне.
- Горюч, легко воспламеним, образует с воздухом взрывные смеси.
Литература
- Brotherton Т. К., Lynn J. W., The synthesis and chemistry of cyanogen, «Chemical reviews», 1959, v. 59, ? 5, р. 841
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.