Сероводород | это... Что такое Сероводород? (original) (raw)
| Сероводород | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование | сульфид водорода |
| Химическая формула | H2S |
| Физические свойства | |
| Состояние (ст. усл.) | газ |
| Отн. молек. масса | 34.082 а. е. м. |
| Молярная масса | 34.082 г/моль |
| Плотность | 1.5206 (н.у.)г/литр г/см³ |
| Термические свойства | |
| Температура плавления | −82.30 °C |
| Температура кипения | −60.28 °C |
| Химические свойства | |
| pKa | 6.89, 19±2 |
| Растворимость в воде | 0.025 (40 °C) |
| Классификация | |
| Рег. номер CAS | 7783-06-4 |
| Безопасность | |
| Токсичность |  4 4 0 4 4 0    |
Сероводоро́д (серни́стый водоро́д, сульфид водорода, дигидросульфид) — бесцветный газ с запахом протухших яиц и сладковатым вкусом. Химическая формула — H2S. Плохо растворим в воде, хорошо — в этаноле. Ядовит. При больших концентрациях разъедает многие металлы. Концентрационные пределы воспламенения с воздухом составляют 4,5 — 45 % сероводорода.
В природе встречается очень редко в виде смешанных веществ нефти и газа. Входит в состав вулканических газов. Образуется при гниении белков. Сероводород используют в лечебных целях, например в сероводородных ваннах.[1]
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Соединения, генетически связанные с сероводородом
- 5 Применение
- 6 Биологическая активность
- 7 Токсикология
- 8 Примечания
- 9 Литература
- 10 Ссылки
Физические свойства
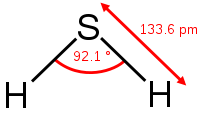
Термически устойчив (при температурах больше 400 °C разлагается на простые вещества — S и H2). Молекула сероводорода имеет угловую форму, поэтому она полярна (μ = 0,34·10−29 Кл·м). В отличие от молекул воды, атомы водорода в молекуле не образуют прочных водородных связей, поэтому сероводород является газом. Раствор сероводорода в воде — очень слабая сероводородная кислота.
Химические свойства
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
 _K_a = 6.9·10−7 моль/л; p_K_a = 6.89.
_K_a = 6.9·10−7 моль/л; p_K_a = 6.89.
Реагирует с основаниями:
 (обычная соль, при избытке NaOH)
(обычная соль, при избытке NaOH)
 (кислая соль, при отношении 1:1)
(кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. На воздухе горит синим пламенем:

при недостатке кислорода:
 (на этой реакции основан промышленный способ получения серы).
(на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или SO42−, например:


Сульфиды
Соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы только сульфиды щелочных металлов, аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок при введении в растворы солей металлов раствора сульфида аммония (NH4)2S. Многие сульфиды ярко окрашены.
Для щелочных и щелочноземельных металлов известны также гидросульфиды M+HS и M2+(HS)². Гидросульфиды Са²+ и Sr2+ очень нестойки. Являясь солями слабой кислоты, растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих металлы в высоких степенях окисления, либо гидроксиды которых являются очень слабыми основаниями (например, Al2S3, Cr2S3 и др.) часто проходит необратимо.
Многие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь).

Получение
- Взаимодействие разбавленных кислот на сульфиды:

- Взаимодействие сульфида алюминия с водой (эта реакция отличается чистотой полученного сероводорода):

- Сплавлением парафина с серой.
Соединения, генетически связанные с сероводородом
Является первым членом в ряде полисульфидов (сульфанов) — H2Sn (n=1±9).
Применение
Сероводород из-за своей токсичности находит ограниченное применение.
- В аналитической химии сероводород и сероводородная вода используются как реагенты для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы.
- В медицине — в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод.
- Сероводород применяют для получения серной кислоты, элементной серы, сульфидов.
- Используют в органическом синтезе для получения тиофена и меркаптанов.
- В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.
Биологическая активность
Сероводород является газотрансмиттером, в микромолярных концентрациях имеет цитопротекторные свойства (антинекротические и антиапоптические). В малых концентрациях стимулирует продукцию cAMP, активирует антиоксидантные системы, имеет противовоспалительное действие. В миллимолярных концентрациях цитотоксичен. [2]
Токсикология
Очень токсичен. Вдыхание воздуха с небольшим содержанием сероводорода вызывает головокружение, головную боль, тошноту, а со значительной концентрацией приводит к коме, судорогам, отёку лёгких и даже к летальному исходу. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус [3]
При большой концентрации ввиду паралича обонятельного нерва запах сероводорода не ощущается.
Примечания
- ↑ Польза сероводородных ванн
- ↑ Szabó C. Hydrogen sulphide and its therapeutic potential. Nature Reviews 2007;6: 918—935
- ↑ Long-term effects on the olfactory system of exposure to hydrogen sulphide / AR Hirsch and G Zavala Smell and Taste Treatment and Research Foundation, Chicago, IL 60611, USA.
Литература
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001
- Малин К. М. Справочник сернокислотчика. — М.: Химия, 1971
Ссылки
- Сернистый водород — статья из Большой советской энциклопедии
- Свойства сероводорода и его токсичность
| Растворимость кислот, оснований и солей в воде |
|---|
| H+ Li+ K+ Na+ NH4+ Ba2+ Ca2+ Mg2+ Sr2+ Al3+ Cr3+ Fe2+ Fe3+ Ni2+ Co2+ Mn2+ Zn2+ Ag+ Hg2+ Hg22+ Pb2+ Sn2+ Cu+ Cu2+ OH− P P P — P М Н М Н Н Н — Н Н Н Н Н — — Н Н Н Н F− P Н P P Р М Н Н М Р Н Н Н Р Р М Р Р М М Н Р Н Р Cl− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н Р Н М — Н Р Br− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н М Н М Р H Р I− P P P P Р Р Р Р Р Р ? Р — Р Р Р Р Н Н Н Н М Н — S2− P P P P — Р М Н Р — — Н — Н Н Н Н Н Н Н Н Н Н Н SO32− P P P P Р М М М Н ? ? М ? Н Н Н М Н Н Н Н ? Н ? SO42− P P P P Р Н М Р Н Р Р Р Р Р Р Р Р М — Н Н Р Р Р NO3− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р — Р — Р Р NO2− P P P P Р Р Р Р Р ? ? ? ? Р М ? ? М ? ? ? ? ? ? PO43− P Н P P — Н Н Н Н Н Н Н Н Н Н Н Н Н Н ? Н Н Н Н CO32− М Р P P Р Н Н Н Н — — Н — Н Н — Н Н — Н — — ? — CH3COO− P Р P P Р Р Р Р Р — Р Р — Р Р Р Р Р Р М Р — Р Р CN− P Р P P Р Р Р Р Р ? Н Н — Н Н Н Н Н Р Н Р — — Н SiO32− H Н P P ? Н Н Н Н ? ? Н ? ? ? Н Н ? ? ? Н ? ? ? |