Трихлорид бора | это... Что такое Трихлорид бора? (original) (raw)
| Трихлорид бора | |
|---|---|
 |
|
 |
|
 |
|
| Общие | |
| Систематическое наименование | хлорид бора(III) |
| Сокращения | трихлоробор |
| Традиционные названия | трихлорид бора, бора хлорид |
| Химическая формула | BCl3 |
| Эмпирическая формула | BCl3 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветный газ, дымится на воздухе |
| Молярная масса | (при 9,23 % и Cl 90,77 % по массе) 117.17 г/моль |
| Плотность | (при 0 °C) 1.326 г/см³ |
| Термические свойства | |
| Температура плавления | -107.3 °C |
| Температура кипения | 12.6 °C |
| Температура вспышки | -17 °C |
| Критическая точка | температура: 178,8 °C давление: 3,87 мПа плотность: 0,7 г/см³ |
| Молярная теплоёмкость (ст. усл.) | 107 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -427 кДж/моль |
| Давление пара | (при −92 °C) 1 мм.рт.ст. (при −68 °C) 10 мм.рт.ст. (при −33,5 °C) 100 мм.рт.ст. (при 20 °C) 150 кПа |
| Химические свойства | |
| Растворимость в воде | разлагается |
| Растворимость в остальных веществах | разлагается в этаноле, растворим в тетрахлориде углерода |
| Оптические свойства | |
| Показатель преломления | 1.00139 |
| Структура | |
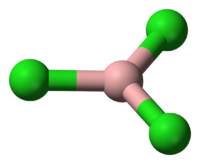
| Координационная геометрия | тригональная, плоская |
| Дипольный момент | 0 Д |
| Классификация | |
| Рег. номер CAS | 10294-34-5 |
| SMILES | [BH6+3].[Cl-].[Cl-].[Cl-] |
| Регистрационный номер EC | 233-658-4 |
| RTECS | ED1925000 |
| Безопасность | |
| Токсичность |  0 4 2 0 4 2  |
Трихлорид бора — это бинарное неорганическое соединение бора и хлора с формулой BCl3. Это бесцветный газ.
Физические свойства
При стандартных условиях трихлорид бора представляет собой тяжёлый бесцветный газ, вследствие взаимодействия с парами воды дымящийся во влажном воздухe.
При нормальных условиях — это жидкость, давление пара которой описывается уравнением:

В Твёрдом состоянии трихлорид бора образует кристаллы гексагональной сингонии, пространственная группа P63, a =0,6140 нм, c = 0,6603 нм, Z = 9.
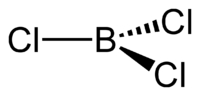
Молекула трихлорида бора представляет собой правильный треугольник (как и другие тригалогениды бора) с длиной связи B—Cl 0,175 нм. Вследствие тригональной симметрии молекула имеет нулевой дипольный момент.
Относительное уменьшение расстояние между хлором и бором объясняется значительным вкладом _π_-связи.
Трихлорид бора не образует димеры, хотя есть косвенные свидетельства того, что он может образовывать димеры при очень низких температурах (20 К).
Получение
Трихлорид бора можно синтезировать из элементов:

В промышленности вместо чистого бора используют его сплавы, например ферробор.
Также в промышленности также используют метод хлорирования при температуре ~1000 °C смеси оксида бора и кокса:

В России используется промышленный метод хлорирования карбида бора при температуре 900 - 1000 °C:

Трихлорид алюминия и трифторид бора могут обмениваться галогенами:

В лабораторной практике трихлорид бора получают разложением его аддуктов, например, BCl3S(СН3)2, которые удобны в работе, т.к. являются твёрдыми веществами:

Химические свойства
Полностью гидролизуется водой с выделением большого количества тепла:

Реагирует с разбавленными и концентрированными щелочами:

![~\mathsf{BCl_3 + 4NaOH \rightarrow Na[B(OH)_4] + 3NaCl}](https://dic.academic.ru/dic.nsf/ruwiki/930ce023dd7205d7b0aa170be1e48290.png)
Восстанавливается водородом до бора или борана:


Горит в кислороде (на воздухе при температуре >400°С):

Фтор вытесняет хлор из соединения:

Трихлорид бора является кислотой Льюиса, которая образует аддукты с третичными аминами, фосфинами, эфирами, тиоэфирами и галогенид-ионами:

Реагирует с оловоорганическими соединениями:

При пропускании через трихлорид бора электрической искры получаются низшие хлориды бора B2Cl6, B4Cl4, B8Cl8:

Реагирует со спиртами с образованием эфиров-боратов:

При нагревании реагирует с борным ангидридом с образованием оксихлорида бора:

Металлы могут восстанавливать трихлорид бора до бора или образовывать бориды:


Применение
- Треххлористый бор является исходным материалом для производства чистого бора.
- Он также используется в переработке алюминия, магния, цинка и сплавов меди для удаления нитридов, карбидов и оксидов из расплавленного металла.
- Трихлорид бора использовался как флюс для пайки сплавов алюминия, железа, цинка, вольфрама и медно-никелевого сплава.
- Обработка жидкого алюминия парами трихлорида бора улучшает качество отливок.
- Используется при изготовлении электрических сопротивлений для приклеивания углеродной пленки к керамической основе.
- Используется в плазменном травлении в производстве полупроводников.
- Используется как реагент в органическом синтезе.
Безопасность
Трихлорид бора является агрессивным реагентом.
См. также
- Список высокотоксичных газов
- Карточка вещества (англ.)
| Соединения бора |
|---|
| Арсенид бора (BAs) • Боразол (B3N3H6) • Борная кислота (H3BO3) • Борогидрид натрия (NaBH4) • Диборан (B2H6) • Карбид бора (B4C) • Метаборат натрия (NaBO2) • Нитрид бора (BN) • Оксид бора (B2O3) • Пентаборат натрия (NaB5O8) • Субоксид бора (B6O) • Сульфид бора (B2S3) • Тетраборан (B4H10) • Тетраборат натрия (Na2B4O7) • Тетрагидридоборат лития (Li[BH4]) • Тетрафторид бора (B2F4) • Тетрафтороборат водорода (H[BF4]) • Тетрафтороборат натрия (Na[BF4]) • Трибромид бора (BBr3) • Трииодид бора (BI3) • Трифторид бора (BF3) • Трихлорид бора (BCl3) • Фосфид бора (BP) |