Альфа-спираль | это... Что такое Альфа-спираль? (original) (raw)

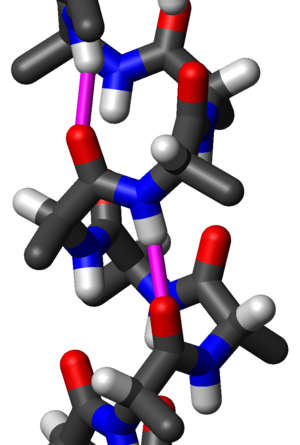
Вид сбоку альфа-спирали созданной из остатков аланина с атомарным разрешением. Водородные связи обозначены красно-фиолетовым цветом, расстояние между атомами водорода и кислорода 2,08 Å (208 пм). Полипептидная цепочка направлена вверх, то есть его N-конец находится внизу, а C-конец — вверху. Отметьте, что боковые цепи аминокислот направлены несколько книзу, в направлении N-конца.
Альфа-спираль (α-спираль) — типичный элемент вторичной структуры белков, которая имеет форму правозакрученой винтовой линии, и в которой каждая аминогруппа (-NH2) в каркасе образует водородную связь с карбонильной группой (-C=O) аминокислоты, находящийся на 4 аминокислоты раньше (водородная связь  ). Этот элемент вторичной структуры иногда также называется классической альфа-спиралью Полинга-Кори-Брэнсона по именам авторов, впервые описавших эту структуру[1][2].
). Этот элемент вторичной структуры иногда также называется классической альфа-спиралью Полинга-Кори-Брэнсона по именам авторов, впервые описавших эту структуру[1][2].
Параметры идеальной α-спирали:
- число аминокислотных остатков на виток спирали - 3,6-3,7
- диаметр спирали - 1,5 нм
- шаг спирали - 0,54 нм
- на один аминокислотный остаток приходится 0,15 нм
Такие параметры вычислены исходя из предположения, что конформация всех аминокислотных остатков (углы φ и ψ), входящих в состав α-спирали, одинакова. Однако в реальных белках конформации отдельных аминокислотных остатков немного различаются, что может приводить к небольшому искривлению оси спирали, к разному количеству аминокислотных остатков в витках спирали и т. п.
Примечания
- ↑ PAULING L, COREY RB, BRANSON HR. (1951). «The structure of proteins; two hydrogen-bonded helical configurations of the polypeptide chain». Proc Natl Acad Sci U S A 37: 205—211. DOI:10.1073/pnas.37.4.205. PMID 14816373.
- ↑ PAULING L, COREY RB. (1951). «Atomic coordinates and structure factors for two helical configurations of polypeptide chains». Proc Natl Acad Sci U S A 37: 235—240.. PMID 14834145.