ДМСО | это... Что такое ДМСО? (original) (raw)
| Диметилсульфоксид | |
|---|---|
   |
|
| Общие сведения | |
| Систематическое название | Диметилсульфоксид |
| Синонимы | Метил сульфоксидmethylsulfinylmethaneDMSO, ДМСО |
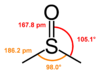
| Молекулярная формула | C2H6OS |
| Молекулярная масса | 78,13 г/моль |
| [67-68-5] | |
| Физические свойства | |
| Плотность | 1.1004 г/см³ |
| Агрегатное состояние | бесцветная жидкость |
| Растворимость в воде | Смешиваются в любыхсоотношениях |
| Растворимость в этаноле, бензоле, хлороформе | Смешиваются в любыхсоотношениях |
| Температура плавления | 18.5 °C (292 K) |
| Температура кипения | 189 °C (462 K) |
| Вязкость | 1.996 спз при 20 °C |
| Константа кислотности | 35 (в ДМСО) |
| Структурные данные | |
| Дипольный момент | 3.96 Д |
| За исключением оговоренных случаев,данные приведены для стандартных условий(при 25 °C, 100 кПа) |
Диметилсульфоксид (ДМСО) — химическое вещество с формулой — (CH3)2SO. Бесцветная жидкость, важный биполярный апротонный растворитель. Нашел широкое применение в различных областях химии, а также в качестве лекарственного средства.
История изучения
Впервые был синтезирован в 1866 г. российским химиком Александром Зайцевым путем окисления диметилсульфида азотной кислотой. В течение нескольких последующих десятилетий исследования свойств этого соединения не имело систематического характера. Интерес к диметилсульфоксиду сильно возрос после того, как в 1958 году было открыта его уникальная растворяющая способность. В 1960 было начато промышленное производство диметилсульфоксида. После этого кол-во публикаций, посвященных изучению свойств ДМСО резко увеличилось.
Получение
Основным способом получения ДМСО является окисление диметилсульфида. В промышленности этот процесс проводят с использованием азотной кислоты. ДМСО является побочным продуктом целюлозно-бумажной промышленности. Годовое производство ДМСО измеряется десятками тысяч тонн.
В лабораторных условиях для мягкого и селективного окисления диметилсульфида может быть использован перйодат калия в системе органический растворитель — вода. Лабораторные способы получения ДМСО не имеют практической значимости. Это обусловлено неудобствами работы с диметилсульфидом, а также низкой коммерческой стоимостью готового растворителя.
Физические и химические свойства
ДМСО — вязкая бесцветная жидкость, почти без запаха. При смешивании с водой сильно нагревается. Реагирует с иодистым метилом, образуя ион сульфоксония, способный к взаимодействию с гидридом натрия.
Применение
Применение в качестве растворителя
ДМСО является важным биполярным апротонным растворителем. Он менее токсичен, чем другие представители этой группы, такие как диметилформамид, диметилацетамид, N-метил-2-пирролидон, ГМФТА. Благодаря своей сильной растворяющей способности, ДМСО часто используется как растворитель в химических реакциях с участием неорганических солей, в частности в реакциях нуклеофильного замещения. Кислотные свойства ДМСО выражены слабо, поэтому он стал важным растворителем в химии карбоанионов. В ДМСО были измерены значения неводных pKa для сотен органических соедиений[1].
Из-за высокой температуры кипения ДМСО крайне медленно испаряется при нормальном атмосферном давлении. Это делает его очень удобным растворителем для проведения реакций при нагревании. В то же время довольно высокая температура плавления ограничивает его применение в области низких температур. После проведения реакции в растворе ДМСО, реакционные смеси чаще всего разбавляют водой для осаждения органических веществ.
Дейтерированная форма ДМСО, известная также как ДМСО-d6, является удобным растворителем для ЯМР-спектроскопии, благодаря высокой растворяющей способности для широкого круга веществ, простоте своего собственного спектра, а также своей стабильности в области высоких температур. Недостатком ДМСО-d6 как растворителя для ЯМР спектроскопии является его высокая вязкость, которая уширяет сигналы в спектре, и высокая температура кипения, которая создает трудности для обратного выделения вещества после анализа. Часто ДМСО-d6 смешивают с CDCl3 или CD2Cl2 для снижения вязкости и температуры плавления.
ДМСО находит все больше способов применения в производстве микроэлектроники [2].
ДМСО как средство для устранения пятен краски является более эффективным и безопасным, чем бензин или дихлорметан.
ДМСО также является единственным средством, удаляющим Супер-клей
Применение в биологии
ДМСО используется в ПЦР для ингибирования спаривания исходных молекул ДНК. Он добавляется к ПЦР смеси перед началом реакции, где он взаимодействует с комплементарными участками ДНК, препятствуя их спариванию и уменьшая количество побочных процессов.[3]
Также ДМСО используется как криопротектор. Он добавляется в клеточную среду для предотвращения повреждения клеток при их заморозке [4]. Примерно 10 % ДМСО может быть использован для безопасного охлаждения клеток, а также для хранения их при температуре жидкого азота.
Применение в медицине
В качестве лекарственного средства очищенный диметилсульфоксид применяется в виде водных растворов (10-50%), как местное противовоспалительное и обезболивающее средство, а также в составе мазей — для увеличения трансдермального переноса действующих веществ, поскольку за несколько секунд проникает через кожу и переносит другие вещества. Торговое название препарата — «Димексид».
Безопасность
Диметилсульфоксид легко проникает через неповреждённую кожу, поэтому растворы токсичных веществ в ДМСО могут привести к отравлению при попадании на кожу (трансдермально). Может раздражать кожу, особенно при действии неразбавленного ДМСО [5]
Примечания
- ↑ "Equilibrium acidities in dimethyl sulfoxide solution," F. G. Bordwell Acc. Chem. Res. 1988, 21, 456, 463; DOI:10.1021/ar00156a004 Bordwell pKa Table in DMSO
- ↑ Kvakovszky, G.; McKim, A.S.; Moore, J. "A Review of Microelectronic Manufacturing Applications Using DMSO-Based Chemistries" ECS Transactions, 11, (2) 227-234 (2007)
- ↑ Chakrabarti R., Schutt C.E. (2001), "The enhancement of PCR amplification by low molecular-weight sulfones", Gene 274 (1-2): 293–298, DOI 10.1016/S0378-1119(01)00621-7
- ↑ Pegg, D.E. (2007), "Principles of cryopreservation", Methods Mol Biol 368: 39-57
- ↑ Experimental Dermatology 1997 Aug;6(4):157-60.
Источники
- Кукушкин Ю.Н. Диметилсульфоксид - важнейший апротонный растворитель // Соросовский образовательный журнал, 1997, 9, С. 54-59.
- Несмеянов А.Н. Начала органической химии. М.1969. Т1, С. 211.
- DMSO - a new clean, unique, superior solvent
Внешние ссылки
- DMSO Material Safety Data Sheet (англ.).
- International Chemical Safety Card 0459 (англ.).
Wikimedia Foundation.2010.