Хлороформ | это... Что такое Хлороформ? (original) (raw)
| Хлороформ | |
|---|---|
 |
|
 |
|
| Общие | |
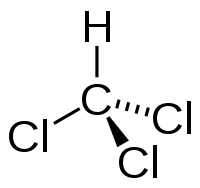
| Химическая формула | CHCl3 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветная жидкость |
| Молярная масса | 119,38 г/моль |
| Плотность | 1,483 г/см³ |
| Термические свойства | |
| Температура плавления | −63,5 °C |
| Температура кипения | 61,2 °C |
| Оптические свойства | |
| Показатель преломления | 1,4467 |
| Классификация | |
| Рег. номер CAS | 67-66-3 |
| SMILES | ClC(Cl)Cl |
| Безопасность | |
| Токсичность | токсично |
Хлорофо́рм (он же трихлормета́н, метилтрихлори́д, хладо́н 20) — органическое химическое соединение с формулой CHCl3. При нормальных условиях бесцветная летучая жидкость c эфирным запахом и сладким вкусом. Практически нерастворим в воде — образует с ней растворы с массовой долей до 0,23 %, — смешивается с большинством органических растворителей. Негорюч. Возможны отравления фосгеном при работе с хлороформом, который долго хранился в тёплом месте[1].
Содержание
- 1 История
- 2 Физические свойства
- 3 Химические свойства
- 4 Получение
- 5 Применение
- 6 Очистка
- 7 Воздействие на организм
- 8 Примечания
История
Хлороформ был впервые получен в 1831 году независимо в качестве растворителя каучука Самуэлем Гутри (Samuel Guthry) затем Либихом (Justus von Liebig) и Суберейном (Eugene Soubeiran).
Формулу хлороформа установил французский химик Дюма (Dumas). Он же и придумал в 1834 г. название «хлороформ», благодаря свойству этого соединения образовывать муравьиную кислоту при гидролизе (лат. formica переводится как «муравей»).
В клинической практике в качестве общего анестетика хлороформ первым применил Холмс Кут (Holmes Coote) в 1847 г., в широкую практику он был внедрён акушером Джеймсом Симпсоном (James Simpson), который использовал хлороформ для уменьшения боли при родах.
В России изобретение медицинского хлороформа принадлежит учёному Борису Збарскому. Открытие химик совершил в 1916 году, когда проживал на Урале в селе Всеволодо-Вильва в Пермском крае.
Физические свойства
- Показатель преломления: 1,44858 при 15 °C.
- Температура кристаллизации: −63,55 C°
- Температура кипения: 61,152 C°
- Дипольный момент: 1,15 Дебай
- Диэлектрическая проницаемость: 4,806 при 20 °C
Химические свойства
Образует азеотропную смесь с водой (т. кип. 56,2 °C, 97,4 % хлороформа).
Получение
В промышленности хлороформ производят хлорированием метана или хлорметана. Реакционную смесь нагревают до температуры 400—500 °C. При этом происходит серия химических реакций. Подобное происходит также при освещении смеси ультрафиолетом.




Результатом процесса является смесь, состоящая из метилхлорида, дихлорметана, хлороформа и тетрахлорметана. Разделение веществ осуществляется дистилляцией.
В лаборатории хлороформ можно получить также по реакции между ацетоном или этанолом и хлорной известью.
Также получить хлороформ в домашних условиях можно путём нагревания трихлоруксусной кислоты до 75 °C.

Поступающий в продажу хлороформ содержит этиловый спирт (1—2 %) в качестве стабилизатора, который связывает образующийся при длительном хранении на свету и в присутствии кислорода фосген. Хлороформ применяют в пробе Бейльштейна, в этой реакции наблюдается окрашивание пламени в голубовато-зелёный цвет ионами меди.

Применение
В конце XIX и начале XX веков хлороформ использовался как анестетик при проведении хирургических операций. Впервые как средство для наркоза хлороформ был применён при хирургических операциях английским врачом Симпсоном (1848 г.). В России хлороформ как средство для общего наркоза впервые применил Н. И. Пирогов. Однако в данной роли хлороформ впоследствии был заменён более безопасными веществами.
Хлороформ используется для производства хлордифторметана — фреона (хладона) 22 путём реакции обмена атомов хлора на фтор при обработке хлороформа безводным фтористым водородом в присутствии хлорида сурьмы(V) (по реакции Свартса)[2][3]:

Хлороформ также используется в качестве растворителя в фармакологической промышленности, а также для производства красителей и пестицидов. Хлороформ, содержащий дейтерий (CDCl3) — наиболее общий растворитель, используемый в ядерном магнитном резонансе (ЯМР).
Очистка
Процесс очистки делится на ряд этапов. Сперва хлороформ встряхивают с концентрированной серной кислотой, промывают водой, сушат над хлоридом кальция либо сульфатом магния и перегоняют. Проверить на чистоту хлороформ можно испарением с фильтровальной бумаги: после хлороформа не должно оставаться запаха. Затхлый, резкий, раздражающий запах говорит о наличии примесей хлора, хлороводорода или фосгена.
Воздействие на организм
Вдыхание хлороформа пагубно влияет на работу центральной нервной системы. Вдыхание около 900 частей хлороформа на 1 миллион частей воздуха за короткое время может вызвать головокружение, усталость и головную боль. Постоянное воздействие хлороформа может вызвать заболевания печени и почек. Приблизительно 10 % населения Земли имеют аллергическую реакцию на хлороформ, приводящую к повышению температуры тела (до 40 °C). Часто вызывает рвоту (частота послеоперационной рвоты достигала 75—80 %).
Исследования на животных показали, что у беременных крыс и мышей, которые дышали смесью, содержащей 30 частей хлороформа на 1 миллион частей воздуха, происходили выкидыши. Также такое наблюдалось у крыс, которым давали хлороформ через рот. Следующие поколения крыс и мышей, которые вдыхали хлороформ, имели больший процент врождённых дефектов, чем у здоровых особей.
Влияние хлороформа на размножение у людей не достаточно хорошо изучено. При длительном воздействии на дыхательные пути и слизистые оболочки человека (2—10 минут) возможен летальный исход. Предположительно мутагенен и канцерогенен. Данные свойства проявляются только при превышении концентрации хлороформа в воздухе.
Примечания
- ↑ Хлороформ ⌬ органические растворители на Chemical Region
- ↑ Промышленные фторорганические продукты: справочное издание / Б.Н. Максимов, В.Г. Барабанов, И.Л. Серушкин и др.. — 2-е, перераб. и доп.. — СПб: «Химия», 1996. — 544 с. — ISBN 5-7245-1043-X
- ↑ Верещагина Н.С., Голубев А.Н., Дедов А.С., Захаров В.Ю. Российский химический журнал.Журнал российского химического общества им. Д.И. Менделеева. — 2000. — Т. XLIV, вып. 2. — С. 110—114.