Хиральность (химия) | это... Что такое Хиральность (химия)? (original) (raw)
Хиральность (молекулярная хиральность) — в химии свойство молекулы быть несовместимой со своим зеркальным отражением любой комбинацией вращений и перемещений в трёхмерном пространстве.

Наряду с конфигурацией и конформацией хиральность — основное понятие современной стереохимии. Хиральностью обладают молекулы, в которых отсутствуют зеркально-поворотные оси симметрии Sn
Руки человека – возможно, наиболее распознаваемый пример хиральности: левая рука не накладывается поверх правой руки; неважно, как расположены руки, невозможно, чтобы все главные особенности обеих рук совпали. Разница в симметрии становится очевидной, если кто-то попытается пожать правую руку друга левой рукой или наденет левую перчатку на правую руку. Термин «хиральность» происходит от древнегреческого χειρ – «рука». При использовании в химическом контексте термин «хиральность» обычно относится к молекулам. Два зеркальных отражения молекулы, которые не накладываются друг на друга, относят как к энантиомерам, так и оптическим изомерам. Из-за того, что разница между правой и левой рукой широко известна и легко распознаётся, многие пары энантиомеров именуются право- и леворукими. Смесь равных количеств двух энантиомеров называется рацематом. Молекулярная хиральность представляет собой интерес из-за возможностей применения в стереохимии, неорганической химии, органической, физикохимии, биохимии и надмолекулярной химии. Симметрия молекулы (или любого другого объекта) определяет, хиральна ли она. Молекула ахиральна (нехиральна) тогда и только тогда, если у неё есть ось ротоинверсии. Это значит, что если после поворота молекулы на 360° и отражения симметрично плоскости, перпендикулярной оси этого вращения, молекула наложится сама на себя. Хиральная молекула необязательно должна быть симметричной, поскольку, лишённая симметричных элементов, у неё может быть радиальная симметрия.
Содержание
- 1 История
- 2 Номенклатура
- 3 Виды хиральности
- 4 Свойства энантиомеров
- 5 Хиральность в биологии
- 6 Хиральность в фармакологии
- 7 Хиральность в неорганической химии
- 8 Хиральность аминов
- 9 Хиральность в литературе
- 10 Ахиральность и прохиральность
- 11 См. также
- 12 Примечания
- 13 Ссылки
История
Термин «оптическая активность» происходит от взаимодействия хиральных материалов с поляризованным светом. Раствор (-)-формы оптического изомера поворачивает плоскость поляризации света против часовой стрелки. Их исследовал в 1815 году Жан-Батист Биот, и эти исследования принесли ощутимую пользу сахарной индустрии, аналитической химии и фармацевтике. Луи Пастер в 1848 году продолжил молекулярные исследования. Он же и придумал термин «рацемичный», происходящий от латинского названия винограда.
Номенклатура
По конфигурации: R- и S-.
Для химиков система R/S – наиболее важная номенклатурная система для характеристики энантиомеров, по которой не надо затрагивать относительную молекулу глицераля. По этой системе, центр хиральности называется R или S в соответствии с системой, по которой каждое замещающее звено наделяется приоритетом в соответствии с правилами Кана-Инголда-Прелога, основываясь на атомном номере. Если центр ориентирован так, что низший из возможных четырёх направлен от наблюдателя, наблюдатель увидит два возможных варианта: если приоритет оставшихся трёх замещающих групп уменьшается по часовой стрелке, название даётся R (Rectus), если уменьшается против часовой стрелки, то S (Sinister). Эта система маркирует каждый хиральный центр молекулы (и также имеет распространение на хиральные молекулы, не затрагивая хиральных центров). Несмотря на это, она более обобщённа, чем система D/L, и может, например, наименовать изомер, в котором (R,R)-группа расположена напротив (R,S) – диастереомер. У системы R/S нет отношения к (+/-)-системе. R-изомер может быть правоповоротным, так и левоповоротным, в зависимости от фактических замещающих групп. У системы R/S нет и отношения к D/L системе. Например, боковая цепочка серина содержит гидроксильную группу –OH. Если тиоловая группа, -SH, поменяется с ней местами, то название D/L, по определению, не будет изменено из-за замены. Но эта замена изменит R/S маркировку молекулы в связи с тем, что приоритет КИП (Кана-Ингольда-Прелога) группы CH2OH ниже, чем у CO2H, но КИП-приоритет CH2SH выше, чем у CO2H. По этой причине система D/L остаётся в повседневном использовании в определённых областях биохимии, таких как аминокислотная и углеводная химия, поскольку удобнее использовать одно и то же хиральное название для всех возможных структур данного типа у высших организмов. По системе D/L, они все являются D, а в системе R/S они в большинстве своём S, но есть много исключений.
По оптической активности: +/-.
Энантиомер именуется по направлению света, в котором вращает плоскость поляризованного света. Если вращение происходит по часовой стрелке (по отношению к наблюдателю, к которому направляется свет), то в названии энантиомера отмечается (+). Его зеркальный образ именуется (-). (+)- и (-)-изомеры также определяются как R и S соответственно (от англ. Rectus – правый и Sinister – левый).
По конфигурации: D- и L-.
Оптический изомер может быть назван по пространственной конфигурации его атомов. Система D/L делает это, опираясь на молекулу глицераля. Сам по себе глицераль хирален, и два его изомера именуются D и L. С глицералем можно провести определённые химические манипуляции без изменения конфигурации, и его историческое использование с этой целью (в совокупности с удобством его использования как одной из наименьших широко используемых хиральных молекул) вылилось в его использование в номенклатуре. В этой системе составные части называются по аналогии с глицералем, который, в общем, производит недвусмысленные обозначения, да к тому же и легче всего увидеть в маленьких биомолекулах, похожих на глицераль. Один пример – аминокислота аланин, у которой есть два оптических изомера, и они именуются в соответствии с тем, от какого стереоизомера глицераля они происходят. С другой стороны, глицин, аминокислота, полученная из глицераля, не обладает оптической способностью, поскольку ахиральна. А аланин, тем не менее, хирален. Маркировка D/L не относится к (+)/(-) никаким образом; она не указывает, какой энантиомер правоповоротный, какой – левоповоротный. Однако она сообщает, что стереохимия соединений имеет отношение к тому, что из право- или левоповоротного энантиомеров глицераля правоповоротный будет D-изомером. Девять из девятнадцати L-аминокислот, найденных в белках, правоповоротные (длина волны 589 нм), а D-фруктоза называется левулоза, поскольку она левоповоротная. Общая закономерность для определения D/L изомерии аминокислот называется правилом “CORN”. Группы COOH, R, NH2 и H (где R – отличная от других углеродная цепь) выстраиваются вокруг атома углерода хирального центра. Если посмотреть так, чтобы атом водорода был направлен вдаль от наблюдателя, а заместители располагались по часовой стрелке вокруг хирального атома углерода, то это будет D-форма. Если против часовой стрелки, то L-форма.
Виды хиральности

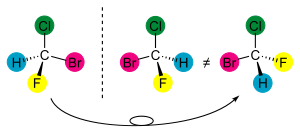
Бромхлорфторметан как пример хиральной молекулы.
Симметрия любой молекулы определяется как наличием тех или иных взаимосвязей между её структурными субъединицами, так и характером (то есть идентичностью или неидентичностью) и геометрическим расположением. При этом в молекулах различных классов возможны самые разные типы взаимного расположения составляющих их субъединиц (лигандов) и их структурные сочетания. Однако, каково бы ни было при этом структурное разнообразие возможных молекулярных систем, в молекулах самых различных классов всегда можно выделить то или иное число воображаемых структурных элементов упорядоченности, основными из которых являются точка, ось, плоскость или спираль. Связанные с этими элементами типы хиральности принято подразделять соответственно на:
- центральную,
- аксиальную,
- планарную,
- спиральную.
Наряду с этим широко известны примеры молекул, которые могут содержать сразу несколько элементов хиральности (например, хиральных центров), одновременно являющихся и естественными элементами их структурной упорядоченности. В целом, у хиральных молекул есть точечная хиральность, центрирующаяся вокруг одного атома, у которого четыре разных замещающих группы. Про два энантиомера такого вещества говорят, что у них различные абсолютные конфигурации вокруг этого центра. Этот центр стереогеничен (т.е. группировка внутри организации молекулы может считаться фокусом стереоизомерии), и таким примером являются α-углерод аминокислот. У молекулы может быть несколько хиральных центров, но сама она может быть ахиральной ввиду элемента симметрии (зеркальная плоскость или центр инверсии), который относится к двум или более хиральным центрам. Такая молекула называется мезоизомером. Также возможно, что молекула хиральна и без точечной хиральности. Примером послужит 1,1’-би-2-нафтол (БИНОЛ) и 1,2-дихлораллен, у которых осевая хиральность, и (E)-циклооктен, у которого плоскостная хиральность. Важно помнить, что молекулы, рассеянные в растворе или находящиеся в газообразном состоянии, обладают значительной гибкостью, и поэтому могут принять множество различных структур. Эти различные структуры сами по себе почти всегда хиральны. Тем не менее, при определении хиральности, надо обязательно использовать структурное изображение молекулы, которое соответствует только одной химической структуре – наиболее симметричной возможной структуре. Когда оптическое вращение энантиомера слишком мало для практического измерения, принято говорить, что наблюдается криптохиральность. Даже изотопные разницы должны учитываться при измерении хиральности. Замена одного из двух атомов 1H на позиции CH2 бензилового спирта дейтерием 2H атом углерода становится стереоцентром. Полученный бензиловый-α-d спирт имеет два отличающихся изомера, что может предназначено для наименований в стереохимии. У S-энантиомера [α]D = +0.715°.
Свойства энантиомеров
Энантиомеры идентичны по отношению к обычным химическим реакциям, но различия появляются, когда они присутствуют в другой хиральной молекуле или объекте. Разные энантиомеры хиральных веществ часто имеют различные запах и вкус и медицинское воздействие (см. ниже). Один хиральный «объект», который по-разному реагирует с двумя энантиомерами хирального вещества, поляризирует свет по кругу: энантиомер поглотит лево- и правополяризованный свет под разными углами. Это основа спектроскопии кругового дихроизма (КД). Обычно разница в поглощаемости относительно мала (тысячные доли). КД-спектроскопия – это мощный аналитический метод, позволяющий исследовать вторичную структуру белка и определять абсолютную конфигурацию хиральных веществ, в частности, переходных металлических комплексов. КД-спектроскопия заменяет поляриметрию как метод, характеризующий хиральные вещества, хотя последняя всё ещё популярна в химии сахаров.
Хиральность в биологии
Многие биологические активные молекулы хиральны, включая аминокислоты природного происхождения (строительные блоки белков) и сахара. Любопытно заметить, что в биосистемах большинство этих веществ имеют одну и ту же хиральность. Большинство аминокислот L, а сахаров – D. Типичные белки природного происхождения, состоящие из L-аминокислот, известны как белки левой формы, а D-аминокислоты составляют белки правой формы.
Происхождение гомохиральности в биологии – предмет множества споров [1][2]. Большинство учёных считает, что выбор хиральности в жизни на Земле был чисто случайным, что, возможно, основанная на углероде инопланетная форма жизни существует где-то во Вселенной, и в ней будет иная форма хиральности. Но некоторые учёные ищут фундаментальные причины выбора хиральности на Земле, такие как слабое взаимодействие.
Энзимы (а они хиральны) часто различаются между двумя энантиомерами хирального субстрата. Представьте, что у энзима впадина в форме перчатки, которая связывает субстрат. Если перчатка как для правой руки, тогда один энантиомер войдёт вовнутрь и свяжется, в то время как другой энантиомер плохо войдёт, и мало шансов, что свяжется. D-форма аминокислот обычно сладкая на вкус, а L-форма обычно вкуса не имеет. Листья перечной мяты и семена тмина содержат L-карвон и D-карвон соответственно – энантиомеры карвона. Они пахнут по-разному, поскольку обонятельные рецепторы большинства людей также содержат хиральные молекулы, которые ведут себя по-разному в присутствии разных энантиомеров.
Хиральность в фармакологии
Множество хиральных лекарств сделаны с высокой энантиометрической чистотой в связи с побочными эффектами другого энантиомера (который может быть даже терапевтически неактивным).
- Талидомид: талидомид рацемичен. Один энантиомер эффективен против тошноты, а другой тератогеничен. В этом случае назначение одного из энантиомеров беременному пациенту не поможет, поскольку оба энантиомера легко преобразуются друг в друга в организме. А если дать человеку другой энантиомер, то и D-, и L-изомеры будут присутствовать в плазме пациента.
- Этамбутол: один энантиомер используется при лечении туберкулёза, другой вызывает слепоту.
- Напроксен: один энантиомер лечит артрит, но другой вызывает отравление печени без анальгетического эффекта.
- Расположение рецепторов стероидов также показывает специфичность стереоизомеров.
- Активность пенициллина стереозависима. Антибиотик должен подражать D-аланиновым цепям, которые присутствуют в клеточных стенках бактерий, чтобы реагировать с энзимом транспептидазой и постепенно поглощать её.
- Только L-анаприлин является мощным адренорецептором, а D-анаприлин – нет. Тем не менее, у обоих изомеров анаприлина есть местный анестезиальный эффект.
- L-меторфан (левометорфан) – мощный опиоид-анальгетик, а D-изомер, декстрометорфан – диссоциативное средство для облегчения кашля.
- S-карведилол, средство, реагирующее с адренорецепторами, в 100 раз сильнее блокирует β-рецепторы, чем R(+) изомер. Но оба изомера примерно одинаково блокируют α-рецепторы.
- D-изомеры первитина и амфетамина – сильные стимуляторы ЦНС, а L-изомеры обоих средств лишены больших стимулирующих ЦНС свойств, но вместо этого стимулируют ПНС (периферическую нервную систему). Поэтому L-изомер первитина доступен как средство для применения в нос, а декстроизомер запрещён для использования в медицинских целях почти во всех (за редким исключением) странах мира и строго контролируется там, где он разрешён.
- S-амлодипин, чистый оптически активный изомер амлодипина, отвечающий за блокаду кальциевых каналов и вазодилятацию.
- левоцитиризин, RR-цитиризин, антигистаминный препарат, активный блокатор гистаминовых рецепторов в составе цитиризина.
- S-пантапрозол, чистый оптически активный изомер пантапрозола, избирательно блокирующий протонную помпу париетальных клеток слизистой желудка.
- R-рабепрозол, чистый оптически активный изомер рабепрозола, избирательно блокирующий протонную помпу париетальных клеток слизистой желудка.
- дексибупрофен, чистый оптически активный изомер ибупрофена, избирательно блокирующий циклооксигеназу.
- декскетопрофен, чистый оптически активный изомер кетопрофена, избирательно блокирующий циклооксигеназу.
- эсэтодолак, чистый оптически активный изомер иэтодолака, избирательно и селективно блокирующий циклооксигеназу.
- эзомепразол, чистый оптически активный изомер омепрозола, избирательно блокирующий протонную помпу париетальных клеток слизистой желудка.
- S-метопролол, селективный блокатор бетта-адренорецепторов сердца и сосудов, выделенный из рацемического метопролола
- левомицетин.
- хинин.
- хинидин.
- L-лизин.
- L-тироксин.
- L-допа.
- левотирацетам.
- R-сибутрамин. Не применяется широко (вероятно, только в Индии), из за запрета FDA на использование рацемического сибутрамина для лечения ожирения из-за побочных эффектов. По данным индийских исследователей R-сибутрамин максимально лишён этих побочных эффектов, однако не доказана эффективность R-сибутрамина безопасно снижать вес.
- L-карнитин. Используется в пищевых добавках.
Хиральность в неорганической химии
Многие комплексные соединения хиральны, например, хорошо известный комплекс [Ru(2,2’-бипиридин)3]2+, в котором три лиганда бипиридина принимают хиральное расположение в виде пропеллера. В этом случае атом рутения может считаться стереогеничным центром в комплексе с точечной хиральностью. Два энантиомера комплексов, таких как [Ru(2,2’-бипиридин)3]2+, могут обозначаться как Λ (левоповоротная закрутка пропеллера, описанного лигандами) и Δ (правоповоротная закрутка). Гексол – это хиральный кобальтосодержащий комплекс, открытый впервые Альфредом Вернером. Твёрдый гексол важен как первое вещество без углерода, отражающее оптическую активность.
Хиральность аминов
Третичные амины хиральны по принципу, схожему с углеродосодержащими веществами: атом азота несёт четыре разных замещающих группы, включаю одинокую пару. Тем не менее, энергетический барьер инверсии стереоцентра в общем равен около 30 кДж/моль, что значит, что два стереоизомера быстро превращаются друг в друга при комнатной температуре. В результате амины, такие, как NHRR’, не могут быть распознаны по виду, а NRR’R’’ могут быть распознаны, когда R, R’ и R’’ заключены в циклические структуры.
Хиральность в литературе
Хотя во времена Льюиса Кэрролла мало было известно о хиральности, его работа «Алиса в Зазеркалье» содержит предугадывающую отсылку к различным видам биологической деятельности энантиометрических лекарств: «Может, зазеркальное молоко непригодно для питья» - сказала Алиса своей кошке. В романе Джеймса Блиша «Спок должен умереть!» из серии «Звёздный путь» тахион, зеркальный мистеру Споку, как выяснится, украдёт химические реактивы из медицинского отсека и будет использовать их для преобразования определённых аминокислот и противоположно хиральные изомеры.
Ахиральность и прохиральность
Отсутствие хиральности обозначается термином «ахиральность». Ахиральные молекулы могут проявлять индуцированную оптическую активность. Молекулу называют прохиральной, если она может быть превращена в хиральную заменой единственного атома, например, атома водорода в СН2BrCl на фтор. При совмещении в одной молекуле хирального и прохирального фрагментов возникает явление диастереотопии ядер, которое наблюдается в спектрах ядерного магнитного резонанса. На этом основан один из методов обнаружения хиральности молекул.
См. также
Примечания
- ↑ Принцип Левинталя - Программа А. Гордона
- ↑ Возможно ли спонтанное возникновение асимметрии в химической реакции?
 |
В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.Эта отметка установлена декабрь 2008. |
|---|
Ссылки
- А. Борисова Химики сплющили углерод. Gazeta.ru (30.07.2010). — Содержит описание некоторых особенностей хиральности. Архивировано из первоисточника 22 августа 2011. Проверено 22 августа 2010.