Химические источники тока | это... Что такое Химические источники тока? (original) (raw)
Химические источники тока
Хими́ческие исто́чники то́ка (аббр. ХИТ) — устройства, в которых энергия протекающих в них химических реакций непосредственно превращается в электрическую энергию.
Содержание
- 1 История создания
- 2 Принцип действия
- 3 Классификация
- 4 Некоторые виды химических источников тока
- 5 Ссылки
История создания
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа Вольтовым столбом. Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниэля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Принцип действия
Основу химических источников тока составляют два электрода (катод, содержащий окислитель и анод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделённых процессов: на катоде восстановитель окисляется, образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
В современных химических источниках тока используются:
- в качестве восстановителя (на аноде) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (на катоде) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.
Классификация
По возможности или невозможности повторного использования химические источники тока делятся на:
- гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций, невозможно перезарядить;
- электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
- топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор).
Некоторые виды химических источников тока
Гальванические элементы
Смотри также Категория:Гальванические элементы.
| Тип | Катод | Электролит | Анод | Напряжение,В |
|---|---|---|---|---|
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1.56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1.65 |
| Марганцево-магниевый элемент | MnO2 | MgBr | Mg | 2.00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2.55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2.42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1.92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1.36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1.92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1.30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1.8—1.9 |
Другие типы:
- Свинцово-плавиковый элемент
- Медно-окисный гальванический элемент
- Висмутисто-магниевый элемент
- Ртутно-висмутисто-индиевый элемент
- Литий-хромсеребряный элемент
- Литий-висмутатный элемент
- Литий-окисномедный элемент
- Литий-йодсвинцовый элемент
- Литий-йодный элемент
- Литий-тионилхлоридный элемент
- Литий-оксидванадиевый элемент
- Литий-фторомедный элемент
- Литий-двуокисносерный элемент
- Диоксисульфатно-ртутный элемент
- Серно-магниевый элемент
- Хлористосвинцово-магниевый элемент
- Хлорсеребряно-магниевый элемент
- Хлористомедно-магниевый элемент
- Йодатно-цинковый элемент
- Магний-перхлоратный элемент
- Магний-м-ДНБ элемент
- Цинк-хлоросеребряный элемент
- Хлор-серебряный элемент
- Бром-серебряный элемент
- Йод-серебряный элемент
- Магний-ванадиевый элемент
- Кальций-хроматный элемент
Аккумуляторы
Смотри также Категория:Аккумуляторы.
- Лантан-фторидный аккумулятор
- Литий-ионный аккумулятор
- Литий-полимерный аккумулятор
- Марганцево-оловянный элемент
- Никель-цинковый аккумулятор
- Никель-кадмиевый аккумулятор
- Никель-металл-гидридный аккумулятор
- Свинцово-кислотный аккумулятор
- Свинцово-оловянный аккумулятор
- Серебряно-цинковый аккумулятор
- Серебряно-кадмиевый аккумулятор
- Железо-никелевый аккумулятор
- Железо-воздушный аккумулятор
- Цинк-воздушный аккумулятор
- Цинк-хлорный аккумулятор
- Натрий-серный аккумулятор
- Литий-хлорный аккумулятор
- Свинцово-водородный аккумулятор
- Цинк-бромный аккумулятор
- Натрий-Никель-Хлоридный аккумулятор
- Литий-железо-сульфидный аккумулятор
- Литий-фторный аккумулятор
Топливные элементы
Смотри также Категория:Топливные элементы.
Ссылки
| Химические источники тока | |||||||
|---|---|---|---|---|---|---|---|
| Первичные элементы | Гальванический элемент Даниеля | Щелочной аккумулятор | Ртутно-цинковый элемент | Марганцево-цинковый элемент | Серебряно-цинковый аккумулятор | Воздушно-цинковый элемент | 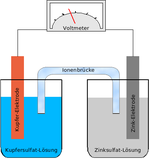 |
|
| Электрические аккумуляторы | Свинцово-кислотный аккумулятор | Никель-кадмиевый аккумулятор | Никель-металл-гидридный аккумулятор | Никель-водородный аккумулятор | Литий-ионный аккумулятор | Литий-полимерный аккумулятор | Литий-титанатный аккумулятор | Ванадиевый аккумулятор |
| Топливные элементы | Прямой метанольный топливный элемент | Твердооксидный топливный элемент | Щелочной топливный элемент | |||||
| Модели | Батарея | Электрический аккумулятор | Концентрационный гальванический элемент | Топливный элемент | ||||
| Устройство | Анод | Катод | Электролит |
| Статьи, относящиеся к электролизу | |
|---|---|
| Начала электролиза | Химические источники тока • Законы Фарадея • Стандартный электродный потенциал |
| Электролитические процессы | |
| Материалы, сделанные электролизом | Алюминий • Металлический кальций • Хлор • Фтор • Водород • Металлический литий • Магний • Металлический калий • Металлический натрий • Гидроксид натрия • Цинк |
| См. также | Электрохимия • |
Wikimedia Foundation.2010.
