tungtvann – Store norske leksikon (original) (raw)
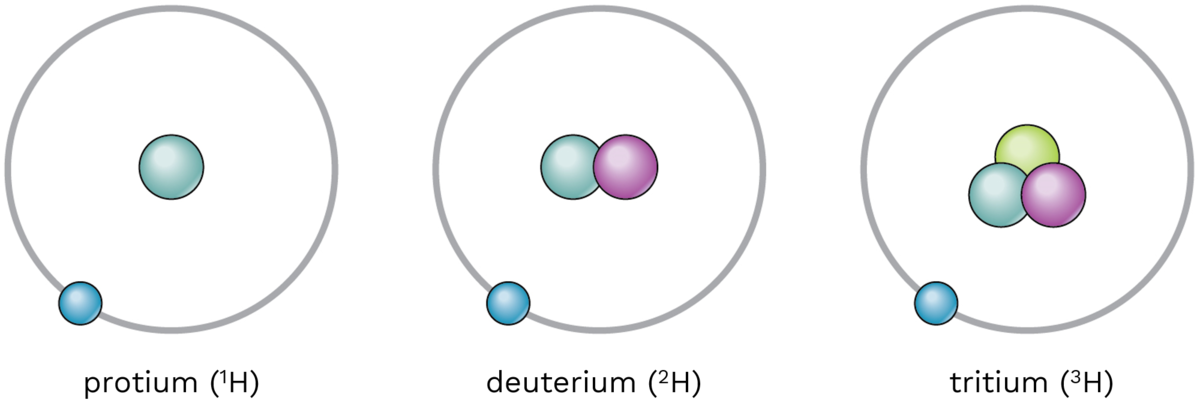
Det finnes tre isotoper av hydrogen: protium, deuterium og tritium. Modellen viser et elektron i bane rundt hydrogenkjernen. Hydrogenkjernen består av ett proton (protium), et proton og et nøytron (deuterium) og et proton og to nøytroner (tritium).
Tungtvann er en spesiell form for vann som spiller en viktig rolle i kjernereaktorer, og som brukes i mange eksperimenter.
Faktaboks
Også kjent som
deuteriumoksid, D2O, tungt vann
Forskjellen på tungtvann og vanlig vann ligger i hvilken isotop av hydrogen det er mest av i vannet. Det finnes tre isotoper av hydrogen: protium, deuterium og tritium. Deuterium er dobbelt så tung som protium. I vanlig vann er det mest protium. I tungtvann er det mest deuterium.
Ved 25 grader celsius (°C) har tungtvann tetthet 1,10452 gram per milliliter (g/mL), mens vanlig vann har 0,99701 g/mL.
Egenskaper
Tungtvann, eller deuteriumoksid (D2O), som er det kjemiske navnet, er en væske uten lukt og smak, som vanlig vann (H2O). Men andre egenskaper til tungtvann er svært forskjellig fra alminnelig vann:
- Smeltepunktet er 3,81 °C
- Normalkokepunktet er 101,42 °C
- Temperaturen for maksimal tetthet er 11,23 °C (for vanlig vann er det 3,98 °C)
Løseligheten av salter i tungtvann er generelt lavere enn i alminnelig vann. Kjemiske reaksjoner går langsommere i tungtvann enn i alminnelig vann. I større mengder er tungtvann helseskadelig som drikkevann.
Tungtvann anvendes i kjernereaktorer, som moderator for å bremse nøytronene slik at disse får den riktige hastigheten, men også som varmeutvekslingsmedium. Brukt tungtvann fra reaktorer er noe radioaktivt på grunn av dannelse av tritium.
Fremstilling
Tungtvann fremstilles industrielt ved elektrolyse av vann, ved kjemiske utbytningsreaksjoner og ved fraksjonert destillasjon av vann eller hydrogen.
Fremstilling i Norge


En ampulle med tungtvann laget av Norsk Hydro.
Kort etter at deuteriumisotopen ble oppdaget i 1932, ble Norsk Hydro klar over at elektrolysecellene de brukte til å fremstille hydrogen- og klorgass på Rjukan var anriket på deuterium. De startet arbeidet med å fremstille tungtvann som et eget produkt, selv om det var uklart den gang om det var et marked for det, bortsett fra til vitenskapelige formål. Tungtvannproduksjonen fortsatte under andre verdenskrig, men i tungtvannsaksjonen ble destillasjonsanlegget ødelagt.
Resten av tungtvannet ble forsøkt sendt til Tyskland i tønner, men fergen ble sprengt på Tinnsjøen 20. februar 1944, og tønnene med tungtvannet sank til bunns. En av tønnene ble tatt opp igjen. Innholdet består av vann som inneholder 1,7 prosent D2O og ni prosent kalilut. I ordinært vann er det 0,0156 prosent deuterium, så tønnene inneholder omtrent hundre ganger så mye. Konsentrasjonen av D2O i tønnene er fortsatt bare 1,7 prosent, og dette er nok grunnen til at ikke alle tønnene er tatt opp fra bunnen av Tinnsjøen.
Elektrolyse
Fremstillingen av deuterium ved elektrolyse beror på at den normale hydrogenisotopen, protium, utlades lettere ved elektrodene enn deuterium. Hydrogenet som unnviker ved elektrolysen, er derfor anriket på protium, mens deuterium blir anriket i elektrolyttluten. Etter lengre tids bruk kan anrikningen i tekniske elektrolyttluter bli fem ganger det opprinnelige innholdet.
Hele prosessen er energikrevende og kan bare utføres når store mengder hydrogen samtidig kan brukes for andre formål, for eksempel til fremstilling av ammoniakk.
Substitusjonssreaksjoner
Fremstillingen ved substitusjonsreaksjoner beror på utbytning av deuterium mellom vann, H2O, og hydrogensulfid, H2S, eller mellom hydrogengass og vann eller ammoniakk. Den første av disse reaksjonene er viktigst for fremstilling av større mengder tungtvann.
Reaksjonen utføres ved så lav anrikningsgrad at deuterium hovedsakelig finnes som HDS i hydrogensulfidet og som HDO i vannet. Fordelingen av deuterium mellom hydrogensulfid og vann bestemmes av utbytningslikevekten:
HDS(g) + H2O(l) ⇆ H2S(g) + HDO(l)
Ved lav temperatur (25 °C) er likevekten forskjøvet mot høyre, og det vil derfor skje en utbytning av D mellom HDS og H2O, slik at D blir anriket i vannet.
Prosessen utføres mest økonomisk ved å benytte seg av at likevekten ved høyere temperatur er mindre forskjøvet mot høyre. Utføres prosessen derfor vekselvis ved lav og høy temperatur (130 °C), ved å la hydrogensulfidgass og vann sirkulere mellom et varmt og et kaldt kolonnetårn, vil hver overgang til ny fase innebære en anrikning av deuterium; ved lav temperatur i vannfasen, og ved høy temperatur i hydrogensulfidgassen.
Anrikningen drives i alminnelighet til cirka 15 molprosent D2O-innhold i vannfasen. Videre anrikning til 90 prosent D2O skjer ved destillasjon ved lavt trykk, og til 99,75 prosent D2O ved elektrolyse. Tungtvann blir i dag fremstilt etter denne metoden i USA og Canada.
Ammoniakk/hydrogenutbytningsreaksjonen:
NH3(l) + HD(g)⇆ NH2D(l) + H2(g)
Denne reaksjonen er gunstigere enn hydrogensulfid/vannreaksjonen for anrikning av deuterium, men den krever en katalysator for å oppnå et brukbart utbytte. En fabrikk med kaliumamid, KNH2, som katalysator ble startet i Frankrike i 1968.
Fraksjonert destillasjon
Fraksjonert destillasjon av flytende hydrogen beror på at deuterium er mindre flyktig enn det lettere protium, som derfor fortrinnsvis unnviker i gassform ved destillasjonen, mens deuterium anrikes i væsken. Til slutt blir fraskilt deuterium brent til tungtvann i oksygen. Denne metoden lar seg også bare utføre i forbindelse med annen anvendelse av hydrogenet.
Fraksjonert destillasjon av vann beror på at vanlig vann ved alle temperaturer har et høyere damptrykk enn deuteriumoksid. Den relative damptrykkforskjellen er størst ved lave temperaturer. Destillasjonen utføres derfor ved lav temperatur, 30–50 °C, og ved forminsket trykk, 6,5–16,5 kilopascal (kPa). Anrikningen drives til omkring 90 molprosent D2O. Sluttanrikning til 99,8 prosent deuterium skjer elektrolytisk.
Typer
Fordi oksygen er en blanding av isotopene 16O, 17O og 18O, finnes det i virkeligheten flere sorter vann (H216O, H217O og H218O), (D216O, D217O og D218O) og (HD16O, HD17O og HD18O). Isotopene 17O og 18O er sågar hyppigere enn deuterium. I vann er det derfor langt mer H218O enn D2O.
Forskjellen i oksygenisotopenes egenskaper er imidlertid så liten at den ikke gjør seg gjeldende, for eksempel ved elektrolyse av vann. Derfor forstår man i alminnelighet med tungtvann deuteriumoksid, D2O. Ettersom tritium anrikes på lignende måte som deuterium, inneholder tungtvann strengt tatt også små mengder tritiumoksid, T2O.