Хронический миелобластный лейкоз | это... Что такое Хронический миелобластный лейкоз? (original) (raw)
| Хронический миелобластный лейкоз | ||
|---|---|---|
 |
||
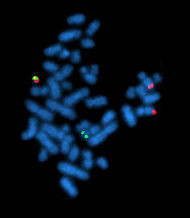
| Филадельфийская хромосома, флюоресцентная гибридизация in situ | ||
| МКБ-10 | C92.192.1 | |
| МКБ-9 | 205.1205.1 | |
| МКБ-О | M9875/3 | |
| DiseasesDB | 2659 | 2659 |
| MedlinePlus | 000570 | 000570 |
| eMedicine | med/371 | med/371 |
| MeSH | D015464 | D015464 |
Хронический миелобластный лейкоз (ХМЛ, хронический миелолейкоз, хронический миелоидный лейкоз) — форма лейкоза, которая характеризуется ускоренной и нерегулируемой пролиферацией преимущественно миелоидных клеток в костном мозге с их накоплением в крови. ХМЛ — гемопоэтическое клональное заболевание, основным проявлением которого является пролиферация зрелых гранулоцитов (нейтрофилов, эозинофилов и базофилов) и их предшественников. Это миелопролиферативное заболевание ассоциировано с характерной хромосомной транслокацией (филадельфийской хромосомой). В настоящее время основным способом лечения хронического миелолейкоза является таргетная (целевая) терапия ингибиторами тирозинкиназ, такими как иматиниб, дазатиниб и другие, значительно улучшившая показатели выживаемости.
Содержание
Патогенез
На примере ХМЛ впервые была показана связь злокачественного заболевания с конкретной генетической аномалией. В случае ХМЛ такой характерной аномалией является хромосомная транслокация, которая проявляется присутствием в кариотипе так называемой филадельфийской хромосомы. Эта мутантная хромосома получила своё название по месту работы её первооткрывателей, Питера Ноуелла (Пенсильванский университет) и Дэвида Хангерфорда (Онкологический центр Фокса Чейза), которые впервые описали её в 1960 году в Филадельфии (штат Пенсильвания, США)[1].
При этой транслокации, участки 9-й и 22-й хромосом меняются местами. В результате, фрагмент гена BCR из хромосомы 22 и ген ABL из хромосомы 9 образуют единую рамку считывания. Продуктами этого аномального слитого гена могут быть белки с молекулярной массой 210 (p210) или, реже, 185 кДа (p185). Так как в норме белок ABL содержит тирозинкиназный домен, продукт мутантного гена также является тирозинкиназой[2][3].
Белок BCR-ABL взаимодействует с одной из субъединиц клеточного рецептора к интерлейкину 3. Транскрипция гена BCR-ABL происходит непрерывно и не нуждается в активации другими белками. BCR-ABL активирует сигнальный каскад, контролирующий клеточный цикл, ускоряя деление клеток. Более того, белок BCR-ABL подавляет репарацию ДНК, вызывая неустойчивость генома и делая клетку более восприимчивой к дальнейшим генетическим аномалиям. Активность BCR-ABL — патофизиологическая причина хронического миелолейкоза. По мере изучения природы белка BCR-ABL и его тирозинкиназной активности, была разработана таргетная (целевая) терапия, позволяющая специфически ингибировать эту активность. Ингибиторы тирозинкиназ могут способствовать полной ремиссии ХМЛ, что ещё раз подтверждает ведущую роль BCR-ABL в развитии заболевания[3].
Клиническая картина
Заболевание часто протекает бессимптомно, выявляясь при рутинном клиническом анализе крови. В этом случае ХМЛ следует дифференцировать от лейкемоидной реакции, при которой мазок крови может имееть схожую картину. ХМЛ может проявляться недомоганием, субфебрильной лихорадкой, подагрой, повышенной восприимчивостью к инфекциям, анемией, тромбоцитопенией с кровоточивостью (хотя также может наблюдаться повышенное содержание тромбоцитов). Также отмечается спленомегалия.[2][4]
Стадии ХМЛ
В течении ХМЛ выделяют три фазы на основании клинических характеристик и лабораторных данных. В отсутствие лечения ХМЛ обычно начинается с хронической фазы, в течение нескольких лет прогрессирует в фазу акселерации и, в конечном счёте, завершается бластным кризом. Бластный криз — терминальная фаза ХМЛ, клинически подобная острому лейкозу. Вовремя начатое медикаментозное лечение, как правило, может остановить прогрессирование болезни по этому пути. Одним из факторов прогресии от хронической фазы к бластному кризу является приобретение новых хромосомных аномалий (в дополнение к филадельфийской хромосоме)[2]. Некоторые пациенты к моменту постановки диагноза могут находиться уже в фазе акселерации или бластного криза[4].
Хроническая фаза
Около 85 % пациентов с ХМЛ к моменту постановки диагноза находятся в хронической фазе. В течение этой фазы клинические проявления обычно отсутствуют или имеются «лёгкие» симптомы, такие как недомогание или чувство переполнения живота. Продолжительность хронической фазы различна и зависит от того, насколько рано было диагностировано заболевание, а также от проведённого лечения. В конечном счёте, при отсутствии эффективного лечения, заболевание переходит в фазу акселерации[4].
Фаза акселерации
Диагностические критерии перехода в фазу акселерации могут различаться: наиболее широко используются критерии, установленные исследователями онкологического центра Андерсона при Техасском университете[5], Сокалом с соавторами[6], а также Всемирной организацией здравоохранения[7][8]. Критерии ВОЗ, вероятно, наиболее широко распространены, и отличают фазу акселлерации по следующим признакам:
- 10—19 % миелобластов в крови или костном мозге;
- > 20 % базофилов в крови или костном мозге;
- < 100 000 тромбоцитов в микролитре крови, вне связи с терапией;
- > 1 000 000 тромбоцитов в микролитре крови, вне зависимости от терапии;
- цитогенетическая эволюция с развитием новых аномалий в дополнение к филадельфийской хромосоме;
- прогрессирование спленомегалии или увеличение числа лейкоцитов, вне зависимости от терапии.
Фаза акселерации предполагается при наличии любого из указанных критериев. Фаза акселерации указывает на прогрессию заболевания и приближение бластного криза[7]
Бластный криз
Бластный криз — финальная стадия развития ХМЛ, протекающая, подобно острому лейкозу, с быстрой прогрессией и непродолжительной выживаемостью[4]. Бластный криз диагностируется на основе одного из следующих признаков у пациента с ХМЛ[9]:
- >20 % миелобластов или лимфобластов в крови или костном мозге;
- крупные группы бластов в костном мозге при биопсии;
- развитие хлоромы (солидного фокуса лейкемии вне костного мозга).
Диагностика

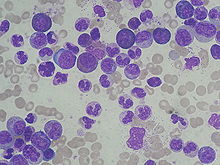
Периферическая кровь (окраска Май-Грюнвальд — Гимза): лейкоцитоз со сдвигом влево
Предположение о ХМЛ часто делается на основании общего анализа крови, демонстрирующего повышение количества гранулоцитов всех типов, включая зрелые миелоидные клетки. Количество базофилов и эозинофилов повышено практически всегда, что позволяет дифференцировать ХМЛ и лейкемоидную реакцию. При диагностике ХМЛ часто проводится биопсия костного мозга, однако одной лишь морфологической оценки костного мозга недостаточно для постановки диагноза ХМЛ[3][4].
В конечном счёте, ХМЛ диагностируется посредством выявления филадельфийской хромосомы в образцах костоного мозга. Эта характерная хромосомная аномалия может быть выявлена в результате цитогенетического анализа, при помощи флюоресцентной гибридизации in situ или детекции гена BCR-ABL методом ПЦР[4].
Существуют разногласия в отношении так называемого Ph-негативного ХМЛ, или случаев предполагаемого ХМЛ, при котором филадельфийская хромосома не обнаруживается. У многих таких пациентов в действительности имеют место комплексные хромосомные аномалии, маскирующие транслокацию t(9;22), либо эта транслокация обнаруживается только при флюоресцентной гибридизации или ПЦР с обратной транскрипцией, но не при при рутинном кариотипировании[10]. Для небольшой подгруппы пациентов с отсутствием молекулярных свидетельств присутствия гена BCR-ABL может быть поставлен диагноз недифференцированное миелодиспластическое/миелопролиферативное расстройство, так как оно, как правило, отличается от ХМЛ по клиническому течению[7].
Примечания
- ↑ Nowell PC (2007). «Discovery of the Philadelphia chromosome: a personal perspective». Journal of Clinical Investigation 117 (8): 2033–2035. DOI:10.1172/JCI31771. PMID 17671636.
- ↑ 1 2 3 Faderl S, Talpaz M, Estrov Z, Kantarjian HM (1999). «Chronic myelogenous leukemia: biology and therapy». Annals of Internal Medicine 131 (3): 207–219. PMID 10428738.
- ↑ 1 2 3 Hehlmann R, Hochhaus A, Baccarani M; European LeukemiaNet (2007). «Chronic myeloid leukaemia». Lancet 370 (9584): 342–50. DOI:10.1016/S0140-6736(07)61165-9. PMID 17662883.
- ↑ 1 2 3 4 5 6 Tefferi A (2006). «Classification, diagnosis and management of myeloproliferative disorders in the JAK2V617F era». Hematology Am Soc Hematol Educ Program 2006: 240–245. DOI:10.1182/asheducation-2006.1.240. PMID 17124067.
- ↑ Kantarjian H., Dixon D., Keating M., Talpaz M., Walters R., McCredie K., Freireich E. (1988). «Characteristics of accelerated disease in chronic myelogenous leukemia». Cancer 61 (7): 1441–6. DOI:10.1002/1097-0142(19880401)61:7<1441::AID-CNCR2820610727>3.0.CO;2-C. PMID 3162181.
- ↑ Sokal J., Baccarani M., Russo D., Tura S. (1988). «Staging and prognosis in chronic myelogenous leukemia». Semin Hematol 25 (1): 49–61. PMID 3279515.
- ↑ 1 2 3 Tefferi A, Thiele J, Orazi A, Kvasnicka HM, Barbui T, Hanson CA, Barosi G, Verstovsek S, Birgegard G, Mesa R, Reilly JT, Gisslinger H, Vannucchi AM, Cervantes F, Finazzi G, Hoffman R, Gilliland DG, Bloomfield CD, Vardiman JW (2007). «Proposals and rationale for revision of the World Health Organization diagnostic criteria for polycythemia vera, essential thrombocythemia, and primary myelofibrosis: recommendations from an ad hoc international expert pane». Blood 110 (4): 1092–1097. DOI:10.1182/blood-2007-04-083501. PMID 17488875.
- ↑ Vardiman J., Harris N., Brunning R. (2002). «The World Health Organization (WHO) classification of the myeloid neoplasms». Blood 100 (7): 2292–302. DOI:10.1182/blood-2002-04-1199. PMID 12239137. Проверено 2007-09-22.
- ↑ Karbasian Esfahani M, Morris EL, Dutcher JP, Wiernik PH (2006). «Blastic phase of chronic myelogenous leukemia». Current Treatment Options in Oncology 7 (3): 189–199. DOI:10.1007/s11864-006-0012-y. PMID 16615875.
- ↑ Savage DG; Szydlo RM; Goldman JM (1997). «Clinical features at diagnosis in 430 patients with chronic myeloid leukaemia seen at a referral centre over a 16-year period». Br J Haematol 96 (1): 111–116. DOI:10.1046/j.1365-2141.1997.d01-1982.x. PMID 9012696.
См. также
 Кровь Кровь |
|
|---|---|
| Кроветворение | Костный мозг человека • Эритропоэз • Лейкопоэз |
| Компоненты | Плазма • Эритроциты • Гематокрит • Тромбоциты • Лейкоциты (Гранулоциты (Нейтрофилы • Эозинофилы • Базофилы) • Агранулоциты (Лимфоциты (T- • B- • NK-) • Моноцит)) |
| Биохимия | Группа крови • Резус-фактор • Буферные системы (Ацидоз • Алкалоз) • Сыворотка • Гликемия (Гипер- • Гипо-) |
| Заболевания | Анемия • Лейкоз • Коагулопатия (Гемофилия • Болезнь Виллебранда) |
| См. также | Гематология |