svovelsyre – Store norske leksikon (original) (raw)
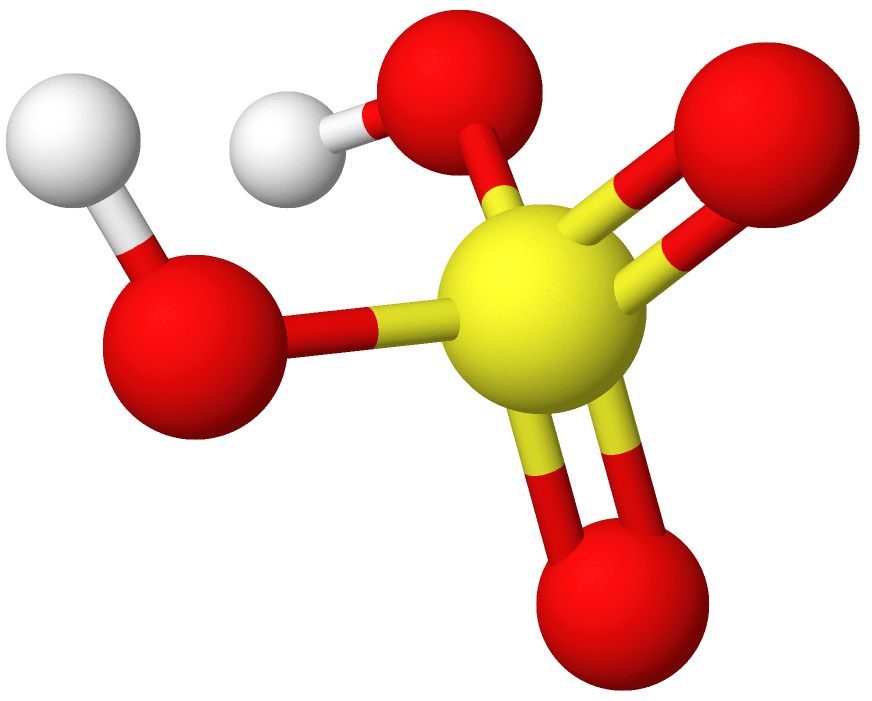
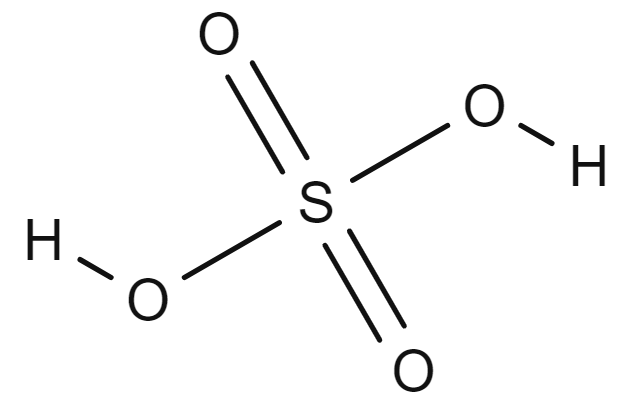
Strukturformel for svovelsyre. H står for hydrogen, O for oksygen og S for svovel.
Svovelsyre er en syre. Ren svovelsyre er en fargeløs, viskøs, oljeaktig, luktfri væske som fryser ved 10 grader celsius.
Faktaboks
Også kjent som
acidum sulfuricum
Bruttoformelen til svovelsyre er H2SO4 og strukturformelen (HO)2SO2. Det kjemiske navnet på svovelsyre er hydrogensulfat.
Svovelsyre er det kjemikaliet som det fremstilles mest av i verden. Det brukes blant annet i produksjon av kunstgjødsel og til fremstilling av andre syrer.
Når konsentrert svovelsyre løses i vann, blir løsningen svært varm; reaksjonen er eksoterm. Det er derfor viktig å aldri helle vann i svovelsyre når syren skal blandes med vann, men helle syren forsiktig i vannet.
Svovelsyre forekommer i noen varme kilder i Colombia, i Tennessee og på Java, hvor den blir dannet ved reaksjon mellom overhetet vanndamp og jern(II)sulfat. Saltene av svovelsyre foreligger i naturen i form av tallrike sulfater. Planter og dyr inneholder løste sulfater, og for plantenes vekst er et visst innhold av sulfater i jorden nødvendig (se svovel).
Kjemiske og fysiske egenskaper

Konsentrert svovelsyre
Tettheten av 100 prosent svovelsyre ved 25 grader er 1,83 gram per milliliter. Den har smeltepunkt 10,4 grader. Smeltepunktet nedsettes av små mengder vann, og for en 98 prosent hydrogensulfat ligger det for eksempel ved 3,0 grader.
Ved oppvarming til 150 grader begynner svovelsyre å ryke av en tett, hvit, sterkt irriterende svoveltrioksidholdig damp. Varmes 100 prosent hydrogensulfat opp til koking, unnviker mer svoveltrioksid enn vann inntil man får en konstant kokende (azeotrop) blanding med 98,3 prosent hydrogensulfat. Denne blandingen har kokepunkt 338 grader og tetthet 1,841 gram per milliliter.
Konsentrert svovelsyre får man ved å destillere fortynnet svovelsyre. Man kan ikke fremstille 100 prosent svovelsyre ved inndampning av fortynnede løsninger. Slik syre kan fås ved å lede en beregnet mengde svoveltrioksid inn i den cirka 98 prosent sterke løsningen.
Kokepunktet for 100 prosent svovelsyre er 279,6 grader. Svovelsyren løser ytterligere svoveltrioksid under dannelse av oleum eller rykende svovelsyre, kalt slik fordi den avgir svoveltrioksid som med luftens fuktighet danner fine dråper av svovelsyre.
Bruksområder
Som syre
Svovelsyre fortynnet med vann er en toprotisk syre:
H2SO4 (aq) + H2O(l) ⇆ HSO4−(aq) + H3O+(aq)
HSO4−(aq) + H2O(l) ⇆ SO42−(aq) + H3O+(aq) Ka = 0,012
Den første likevekten er forskjøvet helt til høyre, men ikke den andre.
Svovelsyre danner to rekker av salter: hydrogensulfater (tidligere kalt bisulfater), for eksempel NaHSO4, og sulfater, for eksempel Na2SO4.
Som vanntiltrekkende
Konsentrert svovelsyre fjerner vann fra en rekke forbindelser.
Sukker blir omdannet til karbon og vann i en eksoterm prosess (en populær demonstrasjon):
C12H22O11(s) + H2SO4(l) → 12C(s) + 11H2O(g) + H2SO4(aq)
Som oksidasjonsmiddel
Svovelsyre er ikke et sterkt oksidasjonsmiddel, men konsentrert svovelsyre oksiderer for eksempel kobber til kobber(II)-ioner:
2H2SO4(l) + Cu(s) → SO2(g) + Cu2+(aq) + 2H2O(l) + SO42-(aq)
Som sulfoneringsmiddel
Konsentrert svovelsyre brukes i organisk kjemi til å erstatte et hydrogenatom med en sulfongruppe:
H2SO4(l) + CH3C6H5(l) → CH3C6H4SO3H(s) + H2O(l)
Som tilsetningsstoff i matvarer
Svovelsyre brukes også som tilsetningsstoff i produksjon av bearbeida matvarer, for å justere surheten (pH) til matvaren. Det har E-nummer E 513.
Fremstilling
Frem til 1900 ble svovelsyre fremstilt med blykammermetoden. Etter 1900 har kontaktmetoden vært den dominerende. Begge er beskrevet nedenfor.
Felles for metodene er at man går ut fra svoveldioksid, SO2, som oksideres med luftens oksygen til svoveltrioksid, SO3. Med vann gir SO3 svovelsyre:
2SO2(g) + O2(g) ⇆ 2SO3(g)
SO3(g) + H2O(l) ⇆ H2SO4(l)
Blykammermetoden
Med denne metoden ble svoveldioksid oksidert i luft med nitrogenoksider som katalysatorer. Reaksjonene skjedde i et anlegg som bestod av tre tårn: glovertårnet, blykamrene og Gay-Lussac-tårnet.
Kontaktmetoden
Utgangsmaterialet for svovelsyrefremstillingen er svovel, pyritt (FeS2), svoveldioksidholdige gasser fra røsting av sulfidmalmer av kobber, bly, molybden, nikkel og sink, samt svoveldioksid gjenvunnet fra industrien.
Den dannede svoveldioksid-luftblandingen må være fri for mekaniske forurensninger i form av flygestøv som kan dekke kontaktflaten mot oksidasjonskatalysatoren, og den må være fri for forbindelser som kjemisk sett vil ødelegge («forgifte») katalysatoren.
Rensingen foregår ved vasking i vasketårn ved elektrostatisk gassrensing i elektrofiltre etter den såkalte Cottrell-metoden.
Etter rensing tørkes gassen med konsentrert svovelsyre og ledes inn i kontaktovnen. Som katalysator anvender man vanligvis blandkatalysatorer med vanadiumoksidsulfat, VOSO4, på silikagel som hovedkomponent.
Oksidasjonen av SO2 er eksoterm, og man får optimalt utbytte ved katalysatortemperatur på 450–580 grader. Man utfører temperaturkontroll blant annet ved at den innstrømmende gassen står i varmeutveksling med kontaktmassen (katalysatoren). Frigjort reaksjonsvarme vil dermed forvarme reaksjonsgassene.
I moderne anlegg benytter man to kontaktovner (dobbeltkontaktmetoden). Svoveldioksidgassen utnyttes bedre (minst 99,5 prosent mot før 96–98 prosent), og svoveldioksidutslipp blir vesentlig mindre. Reaksjonen mellom svoveltrioksid og vann til svovelsyre er altfor heftig til at gassblandingen fra kontaktovnen kan ledes direkte inn i vann. I stedet benytter man absorpsjonstårn hvor svoveltrioksid ledes inn i konsentrert svovelsyre (98–99 prosent), under dannelse av disvovelsyre H2S2O7: H2SO4 + SO3 = H2S2O7. Ved deretter å sette avmålte mengder vann til disvovelsyre, kan man fremstille svovelsyre med ønsket konsentrasjon: H2S2O7 + H2O = 2H2SO4.
Kontaktsyren kommer i handelen som konsentrert svovelsyre (98 prosent) eller som rykende svovelsyre.
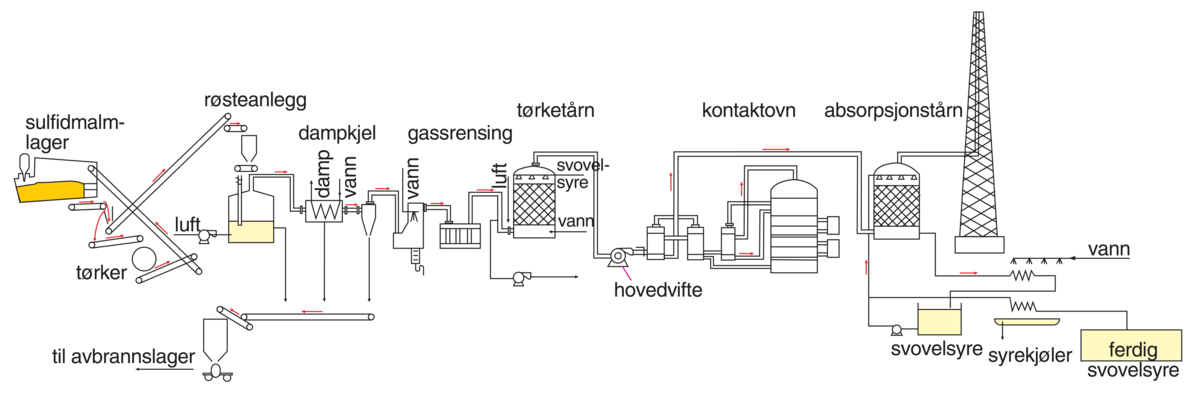
Svovelsyre. Prinsippskisse for kontaktmetoden.
Disvovelsyre
Disvovelsyre, H2S2O7, pyrosvovelsyre, er et fast, gjennomsiktig, krystallinsk stoff med smeltepunkt 36 grader celsius. Den krystalliserer fra rykende svovelsyre med et innhold av 18–62 prosent svoveltrioksid ved avkjøling:
H2SO4(l) + SO3(g) → H2S2O7(s)
Saltene kalles disulfater.
Bruk
Svovelsyre er mest benyttet av alle syrer. Det største forbruket er i kunstgjødselindustrien, hvor man bruker svovelsyre til fremstilling av superfosfat, ammoniumsulfat og fosforsyre. Til sammen utgjør forbruket i denne industrien cirka 60 prosent av hele svovelsyreproduksjonen.
Videre brukes svovelsyre til fremstilling av andre syrer, både uorganiske og organiske. I sprengstoffindustrien blir svovelsyre i blanding med salpetersyre brukt som «nitrersyre» for fremstilling av skytebomull, nitroglyserol, pikrinsyre, trinitrotoluen (TNT) med mer.
Til sulfonering brukes store mengder svovelsyre i organisk-kjemisk industri: i fargestoffindustrien, glassindustrien, fett- og oljeindustrien, rayonindustrien, til fremstilling av sulfater og titandioksid, til beising av metaller, i oljeraffinerier, i farmasøytisk industri med mer. Også til akkumulatorsyre i blybatterier medgår betydelige mengder svovelsyre med tetthet 1,20–1,23 gram per milliliter, som svarer til 27–30 prosent H2SO4.
Historikk
Fremstilling av svovelsyre var kjent allerede av alkymistene og er blant annet omtalt i skrifter av pseudonymet Geber fra cirka 1300. Fremstillingen foregikk ved oppvarming av naturlige sulfater (vitrioler og alun). Senere skjedde fremstilling ved gløding av jern(III)hydroksidsulfat, Fe(OH)SO4, eller jern(III)sulfat, Fe2(SO4)3, som var dannet ved forvitring og oksidasjon av jern(II)sulfat (jernvitriol). Det dannes svoveltrioksid, SO3, som ble løst i svovelsyre og ga rykende svovelsyre.
På denne måten ble svovelsyre fremstilt i Harz og Böhmen allerede i 1526. På grunn av sin opprinnelse og sin oljeaktige, seige konsistens ble syren kalt vitriololje, (eller oleum). Helt frem til siste halvdel av 1800-tallet var dette den eneste metoden til fremstilling av ren konsentrert svovelsyre.
I skrifter fra siste halvdel av 1500-tallet, forfattet av Basilius Valentinus og Andreas Libavius (1550–1616) er fremstilling av svovelsyre ved forbrenning av svovel i nærvær av salpeter omtalt. I 1746 ble det anlagt en fabrikk i Birmingham for teknisk fremstilling av svovelsyre etter denne metoden og bruk av et blykammer. Dette var begynnelse til blykammermetoden.
At svoveldioksid i nærvær av platina som katalysator lar seg oksidere av luft til svoveltrioksid, ble iakttatt av engelskmannen Peregrine Phillips i 1831, men det var først mot slutten av 1800-tallet at metoden fikk industriell betydning.
I Norge
I Norge ble den første svovelsyreproduksjonen etter blykammermetoden satt i gang i av Alfred Nobel i 1859 ved Lysaker Kemiske Fabrik. Den fortsatte der til 1970. Syren ble benyttet til fremstilling av superfosfat.
I 1917 startet Norsk Sprængstofindustri A/S en svovelsyrefabrikk etter kontaktmetoden på Verpen ved Sætre i Hurum. Produksjonen her ble nedlagt i 1968. Ved Borregaard begynte produksjonen av svovelsyre etter kontaktmetoden i 1954 med en kapasitet på 60 tonn syre per døgn. I 1960-årene ble det bygd en ny svovelsyrefabrikk i Sarpsborg med en kapasitet på 600 tonn per døgn basert på pyritt fra Hjerkinn. I 1971 ble anlegget utvidet til en kapasitet på 900 tonn per døgn eller 300 000 tonn per år. Samtidig ble en dobbeltkontaktprosess tatt i bruk slik at utslippet av svoveldioksid til atmosfæren ble redusert fra cirka 450 til 120 kilo i timen.
Ved Boliden Odda AS (tidligere Norzink A/S) er svovelsyreproduksjonen basert på svoveldioksid fra røsting av sfaleritt.
Fysiologiske virkninger
Konsentrert svovelsyre virker ødeleggende på menneskelig, dyrisk og vegetabilsk vev. Svovelsyre som kommer på huden, gir først en følelse av varme. Siden begynner det å svi, og vevet går i oppløsning.
Svovelsyre som er kommet på hud og klær, må raskt tørkes av med en tørr klut og skylles av med store mengder kaldt vann. De siste syrerestene kan nøytraliseres med en løsning av natron eller fortynnet salmiakk.
Konsentrert svovelsyre som svelges, fremkaller under store smerter livsfarlige etsninger i munnhule, spiserør og mage.