Нитрат рубидия | это... Что такое Нитрат рубидия? (original) (raw)
| Нитрат рубидия | |
|---|---|
| Общие | |
| Систематическое наименование | Нитрат рубидия |
| Традиционные названия | Азотнокислый рубидий |
| Химическая формула | RbNO3 |
| Физические свойства | |
| Состояние (ст. усл.) | Белые кристаллы |
| Молярная масса | 147,47 г/моль |
| Плотность | 3,112 г/см³ |
| Термические свойства | |
| Температура плавления | 313; 314 °C |
| Молярная теплоёмкость (ст. усл.) | 99,0 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -494,7 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 53,520; 30980 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,52 |
Нитрат рубидия — соль щелочного металла рубидия и азотной кислоты с формулой (RbNO3). Бесцветный гигроскопический кристаллический порошок, без запаха.
Получение
Нитрат рубидия получается действием азотной кислоты на металлический рубидий, его оксид, гидроксид или карбонат:




Физические свойства
Нитрат рубидия образует бесцветные гигроскопичные кристаллы тригональной сингонии, пространственная группа P 31m, a = 1,045 нм, c = 0,738 нм, Z = 9. При 164°С переходит в кубическую фазу с параметром ячейки a = 0,4380 нм. При 220°С переходит в гексагональную фазу, а при 283°С — в кубическую. Жидкий нитрат рубидия имеет большую плотность (2,395400 г/см³), чем твёрдое вещество. В вакууме при 450-500°С нитрат рубидия возгоняется без разложения, что можно использовать для его очистки. Расплавленный нитрат рубидия сильный окислитель, он разрушительно действует на кварц, платину и другие металлы.
Химические свойства
- При нагревании выше температуры плавления разлагается


- При смешении концентрированных растворов нитрата рубидия и азотной кислоты образуются сольваты (n=1÷2):

также образуются сольваты с перекисью водорода: 7RbNO3•3H2O и 2RbNO3•H2O.
- Нитрат рубидия восстанавливается атомарным водородом:


Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
- Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия. — М.: «Химия», 1970. — 408 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
| Соединения рубидия |
|---|
| Азид рубидия (RbN3) • Амид рубидия (RbNH2) • Алюминий-рубидий сульфат (RbAl(SO4)2) • Ацетат рубидия (RbCH3COO) • Бихромат рубидия (RbCr2O7) • Бромат рубидия (RbBrO3) • Бромид рубидия (RbBr) • Гексафторогерманат рубидия (Rb2[GeF6]) • Гексахлороплатинат(IV) рубидия (Rb2[PtCl6]) • Гидрид рубидия (RbH) • Гидроксид рубидия (RbOH) • Гидроортофосфат рубидия (Rb2HPO4) • Дигидроортофосфат рубидия (RbH2PO4) • Иодат рубидия (RbIO3) • Иодид рубидия (RbI) • Карбонат рубидия (Rb2CO3) • Метаборат рубидия (RbBO2) • Метапериодат рубидия (RbIO4) • Метафосфат рубидия (RbPO3) • Надпероксид рубидия (RbO2) • Нитрат рубидия (RbNO3) • Нитрид рубидия (Rb3N) • Нитрит рубидия (RbNO2) • Озонид рубидия (RbO3) • Оксалат рубидия (Rb2C2O4) • Оксид рубидия (Rb2O) • Ортофосфат рубидия (Rb3PO4) • Перманганат рубидия (RbMnO4) • Пероксид рубидия (Rb2O2) • Перхлорат рубидия (RbClO4) • Рубидий-литий сульфат (RbLiSO4) • Сульфат рубидия (Rb2SO4) • Сульфид рубидия (Rb2S) • Тетрагидридоборат(III) рубидия (Rb[BH4]) • Тригидрооксалат рубидия (RbH3(C2O4)2) • Фторид рубидия (RbF) • Хлорат рубидия (RbClO3) • Хлорид рубидия (RbCl) • Хромат рубидия (Rb2CrO4) |
| Нитраты | |
|---|---|
| Динитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат берилия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2) | 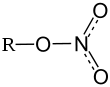 |
| Растворимость кислот, оснований и солей в воде |
|---|
| H+ Li+ K+ Na+ NH4+ Ba2+ Ca2+ Mg2+ Sr2+ Al3+ Cr3+ Fe2+ Fe3+ Ni2+ Co2+ Mn2+ Zn2+ Ag+ Hg2+ Hg22+ Pb2+ Sn2+ Cu+ Cu2+ OH− P P P — P М Н М Н Н Н — Н Н Н Н Н — — Н Н Н Н F− P Н P P Р М Н Н М Р Н Н Н Р Р М Р Р М М Н Р Н Р Cl− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н Р Н М — Н Р Br− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н М Н М Р H Р I− P P P P Р Р Р Р Р Р ? Р — Р Р Р Р Н Н Н Н М Н — S2− P P P P — Р М Н Р — — Н — Н Н Н Н Н Н Н Н Н Н Н SO32− P P P P Р М М М Н ? ? М ? Н Н Н М Н Н Н Н ? Н ? SO42− P P P P Р Н М Р Н Р Р Р Р Р Р Р Р М — Н Н Р Р Р NO3− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р — Р — Р Р NO2− P P P P Р Р Р Р Р ? ? ? ? Р М ? ? М ? ? ? ? ? ? PO43− P Н P P — Н Н Н Н Н Н Н Н Н Н Н Н Н Н ? Н Н Н Н CO32− М Р P P Р Н Н Н Н — — Н — Н Н — Н Н — Н — — ? — CH3COO− P Р P P Р Р Р Р Р — Р Р — Р Р Р Р Р Р М Р — Р Р CN− P Р P P Р Р Р Р Р ? Н Н — Н Н Н Н Н Р Н Р — — Н SiO32− H Н P P ? Н Н Н Н ? ? Н ? ? ? Н Н ? ? ? Н ? ? ? |