Хронология химии | это... Что такое Хронология химии? (original) (raw)
Хронология науки химии — это список различных работ, исследований, идей, изобретений и экспериментов, которые в значительной мере изменили взгляды человечества на строение вещества и материи и процессы происходящие с ними, которые в данный сейчас составляют науку химию. История химиии, как наука, была основана ирландским ученым Робертом Бойлем.
Два основных источника, которые легли в основу современной химии — это идеи натурфилософов (таких как Аристотель и Демокрит), которые использовали дедуктивный метод для описания мира вокруг и алхимиков (таких как Джабир ибн Хайян и Ар-Рази), которые использовали экспериментальные методы для превращения материалов, к примеру в золото.
В XVII веке слияние этих двух источников — дедуктивного и экспериментального — привели к появлению процесса мышления, называемого теперь «научным методом». С его появлением появилась и современная химия.
Развитие химии было тесно связанно с другими науками и развитием технологии. Поэтому многие открытия в химии, также являются важнейшими открытиями в физике, биологии, астрономии, геологии, науках о материалах и других областях знаний.
До XVII века
До появления научного метода и начала его использования в химии, достаточно спорно называть людей описанных в этом разделе «химиками» в современном значении этого слова. Тем не менее, идеи многих великих мыслителей были далеко идущими, основательными и важными для своего времени и послужили базой для появления современной химии.
около 3000 лет до н.э.
Египтяне сформулировали теорию Огдоада или «первоначальных сил» из которых весь мир было создан. В этой теории было восемь элементов хаоса, которые существовали ещё до возникновения Солнца.
около 1900 лет до н. э.
Гермес Трисмегист, полумифическое египетское божество, которое, как принято считать, является основателем искусства алхимии.[1]
около 1200 лет до н. э.
Таппути, парфюмер и первый химик, упомянутый на клинописной дощечке, найденной в Месопотамии.[2] Она использовала цветы и растительные масла, которые перегонялись с водой. Это также первый задокументированный перегонный процесс.[3]
около 450 года до н. э.
Эмпедокл выразил мысль, что все вещи состоят из четырех основных элементов: земли, воздуха, огня и воды, которые взаимодействуют между собой благодаря двум силам притяжения и отталкивания (любви и ненависти или притягательности и антипатии), что приводит к появлению бесконечного разнообразия форм.[4]
около 440 года до н. э.
Левкипп и Демокрит предложили идею про атом, как невидимую частичку из которой все построено. Эта идея была отвергнута натурфилософами в пользу Аристотелевского взгляда.[5][6]

Статуя Платона в Дельфах
около 360 года до н. э.
Платон вводит слово «элемент» («стихия») в своем диалоге Тимей, который содержит дискуссию про состав неживых и живых тел и является первейшим упрощенным трактатом по химии. В нем также говорится, что мельчайшие частички каждого «элемента» имеют свою специфическую геометрическую форму: тетраэдра (огонь), октаэдра (воздух), икосаэдра (вода) и куба (земля).[7]
около 350 года до н. э.
Аристотель, развивая мысли Эмпедокла, предлагает идею про то, что все вещества являются комбинацией материи и формы. Он создает теорию пяти элементов: огня, воды, земли, воздуха и эфира. В западном мире эта теория была общепринятой более 1000 лет.[8]
около 50 года до н. э.
Лукреций публикует свое сочинение «О природе вещей», в котором содержится поэтическое описание идей Атомизма.
около 300 года н. э.
Зосима из Панополиса пишет самую старую из известных книг по алхимии. Алхимию он определяет как изучение структуры воды, движения, роста, материализации и дематериализации, выхода духов из тел и обратного слияния духов с телами.[9]
около 750 года
Джафар ас-Садык критикует теорию Аристотеля про четыре классических «элемента»[10]
около 815 года
Джабир ибн Хайян (известный также как Geber), арабский алхимик, которые многими авторами считается «отцом химии».[11][12][13] Он разработал ранний вариант экспериментального метода исследования в химии и описал множество кислот (включая хлоридную кислоту, азотной кислоту, лимонную кислоту, уксусную кислоту, винную кислоту и царскую водку).[14] Он сделал экспериментальный подход систематичным и основанным на лабораторных исследованиях, что значительно отличалось от подхода его предшественников — древнегреческих и древнеегипетских алхимиков, чьи методы были чаще всего аллегоричны и путанны.[15]
около 850 года
Ал-Кинди (известный также как Alkindus), арабский химик, опровергает алхимические превращения и существование философского камня.[16] Он также дает первое недвусмысленное объяснение получения чистого спирта перегонкой вина.[17]
около 900 года
Мухаммад Ар-Рази (известный также как Rhazes и Abubater), арабский химик, который написал и опубликовал несколько трактатов по химии, которые содержали ранние описания контролируемой дистилляции и экстракции. Он также разработал методы получения серной кислоты[18] и экспериментально опроверг теорию Аристотеля про четыре классических элемента (стихии).[19]
около 1000 года
Аль-Бируни[20] и Авицена[21], обое перские химики, ещё раз опровергли алхимические превращения и существование философского камня.
около 1220 года
Роберт Гроссетест опубликовал некоторые комментарии к работам Аристотеля, в которых создал фундамент будущего научного метода.[22]
около 1250 года
Насир ад-Дин Ат-Туси, персидский химик, описал раннюю версию закона сохранения массы — ничего кроме материального тела не может изменяться и материальное тело не может просто исчезнуть.[23]

Печь для дистилляции (Псевдо-Гебер, XIV в.)
1267 год
Роджер Бэкон опубликовал свое «Большое сочинение» («Opus Majus»), в котором среди других вещей, предложена ранняя форма научного метода и содержаться результаты экспериментов с порохом.[24]
около 1310 года
Псевдо-Гебер, неизвестный испанский алхимик, который писал под именем Гебера, опубликовал несколько книг, в которых была предложена теория что все металлы состоят из разных соотношений атомов серы и ртути.[25]
около 1530 года
Парацельс развит учение ятрохимии, как одной из дисциплин алхимии, которая посвящена продлению жизни человека и которая стала основой для современной фармакологии. Также считается что он был первым, кто употребил слово «химия».[9]
1597 год
Андреас Либавий опубликовал прообраз химического учебника — книгу «Алхимия».[26]
XVII и XVIII века

Сэр Френсис Бэкон
1605 год
Сэр Френсис Бэкон опубликовал «Новый Органон» в котором была изложена суть того, что позже стало называться «научным методом».[27]
1605 год
Михал Сендзивой написал алхимический трактат «Новый свет алхимии», в котором высказал мысль про то, что в воздухе содержится «пища для жизни», которая позже была определена как кислород.[28]
1615 год
Жан Бегуин опубликовал Tyrocinium Chymicum, учебник химии, в котором было написано первое уравнение химической реакции.[29]
1637 год
Рене Декарт написал Рассуждение о методе…, в которых содержалось развитие теории научного метода .[30]
1648 год
посмертная публикация книги Ortus medicinae Ян Баптист ван Гельмонт, работа которого считается одной из основных по химии и алхимии этого периода, и которая имела значительное влияние на Роберта Бойля. Эта книга содержит результаты многих экспериментов и раннюю версию закона сохранения массы.[31]

Титульная страница книги Роберта Бойля The Sceptical Chymist (1662 года издания)
1660 год
Роберт Бойль публикует книгу Скептический химик (The Sceptical Chymist) — трактат о различиях между химией и алхимией. Книга также содержит идеи про атомы, молекулы и химические реакции. Именно эта книжка считается началом современной химии.[32]
1662 год
Роберт Бойль предлагает, описывающий поведение газов в зависимости от изменения объема и давления. В 1676 году закон переоткрыт Эдмом Мариоттом и стал называться законом Бойля-Мариотта.[32]
1735 год
Шведский химик Георг Брандт проводит анализ темно-синего пигмента найденного в медной руде. Брандт показывает, что пигмент содержит новый элемент, позже названный кобальтом.
1754 год
Джозеф Блэк при нагревании магнезии получает «связанный воздух» — углекислый газ.[33]
1758 год
Джозеф Блэк формулирует концепцию спрятанного тепла, чтобы объяснить термохимию фазовых переходов.[34]
1766 год
Генри Кавендиш открывает водород, как газ без цвета и запаха, который образовывает с воздухов взрывоопасные смеси.
1773-1774 годы
Карл Вильгельм Шееле и Джозеф Пристли независимо друг от друга открывают кислород. Пристли называет его "дефлогистированный воздух", а Шееле - "горящий воздух".[35][36]

Антуан Лоран Лавуазье (1743—1794)
1778 год
Антуан Лоран Лавуазье, многими называемый «отцом современной химии»[37], открыл и предложил название кислород и описал его важную роль в горении.[38]
1787 год
Антуан Лоран Лавуазье опубликовал книгу Методы номенклатуры в химии (Méthode de nomenclature chimique) — первую систему химической номенклатуры.[38]
1787 год
Жак Шарль предлагает закон Шарля — следствие из закона Бойля-Мариотта, который описывает связь между температурой и объемом газов.[39]
1789 год
Антуан Лавуазье публикует Элементарный трактат по химии (Traité Élémentaire de Chimie) —

Вольтов столб
первый современный учебник химии. Это первый полный обзор химии того времени, который включает первое описание заона сохранения массы и содержит основы стехиометрии и точных расчетов в химическом анализе.[38][40]
1797 год
Жозеф Пруст предлагает закон постоянства состава, который утверждает, что количества элементов, входящих в состав веществ, соотносятся как целые небольшие числа.[41]
1800 год
Алессандро Вольта создает первый гальванический элемент — Вольтов столб, закладывая тем самым основы электрохимии.[42]
XIX век

Джон Дальтон (1766—1844)
1803 год
Джон Дальтон предложил законы Дальтона, которые описывают соотношение между компонентами в смеси газов и вклад каждого компонента в суммарное давление смеси.[43]
1805 год
Жозеф Гей-Люссак показал что вода состоит из двух частей водорода и одной части кислорода.[44]
1808 год
Жозеф Гей-Люссак описал и исследовал некоторые химические и физические свйоства воздуха и других газов, экспериментально доказал законы Бойля-Мариотта и Шарля и показал взаимосвязь между плотностью и составом газов.[45]
1808 год
Джон Дальтон опубликовал Новая система химической философии (New System of Chemical Philosophy) книгу, которая содержит первое современное научное описание атомистической теории и полноценную формулировку закона кратных отношений.[43]
1808 год
Йёнс Якоб Берцелиус опубликовал Lärbok i Kemien, в которой предложил современные химические символы элементов и концепцию относительной атомной массы.[46]
1811 год
Амедео Авогадро предложил закон Авогадро, про то, что одинаковые объемы газов при одинаковом давлении и температуре содержат одинаковое количество молекул.[47]

Структурная формула мочевины
1825 год
Фридрих Вёлер и Юстус Либих провели первое подтвержденное исследование и описание изомеров (название дал Берцелиус). Работая с циановой и фульминовой кислотой, они пришли к выводу что изомерия является результатом перестановки атомов в молекулах.[48]
1827 год
Вильям Проут классифицировал биомолекулы на современные группы: углеводы, белки и липиды.[49]
1828 год
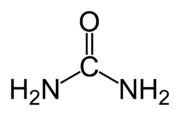
Фридрих Вёлер синтезировал мочевину, показав таким образом что органические соединения могут быть синтезированы из неорганических веществ, тем самым опроверг теорию витализма.[48]

Бензил ацетат имеет эстерную функциональную группу (показанно красным), ацетильную группу (зелёная) и бензильную группу (оранжевая).
1832 год
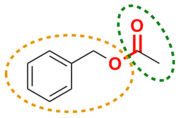
Фридрих Вёлер и Юстус Либих описали и объяснили понятие функциональной группы и начали изучение химии радикалов в органической химии.[48]
1840 год
Герман Гесс предложил закон Гесса — начальную форму закона сохранения энергии, который утверждал, что изменение энергии в химическом процессе зависит только от состояния реагентов и продуктов и не зависит от пути, по которому проходит реакция между этими состояниями.[50]
1847 год
Адольф Герман Кольбе синтезировал уксусную кислоту из неорганический веществ, окончательно опровергнув теорию витализма.[51]
1848 год
Лорд Кельвин вводит понятие абсолютного нуля — температуры при которой любое движение молекул останавливается.[52]

Луи Пастер
1849 год
Луи Пастер показал, что рацемат винной кислоты является смесью декстровинной и левовинной кислоты, тем самым объяснив природу оптического вращения и внеся вклад в развитие стереохимии.[53]
1852 год
Август Бер предложил закон Бера, который описывает взаимосвязь между составом смеси и количеством света, который она поглощает. Основываясь на более ранних работах Пьера Бугера и Иоганна Генриха Ламберта, он создал новую аналитическую методику — спектрофотометрию.[54]
1855 год
Бенджамин Силлиман младший сделал пионерские исследования в области крекинга нефти, что позволило развиться современной нефтехимической промышленности.[55]
1856 год
Сэр Уильям Перкин синтезировал мовеин — первый синтетический краситель. Он был получен как случайный побочный продукт при попытке синтеза хинина из каменноугольной смолы. Это исследование стало началом промышленного производства синтетических красителей — одной из наиболее ранних областей химического синтеза.[56]

Структура бензола по Кекуле
1857 год
Фридрих Август Кекуле высказал предположение что углерод в органических соединениях четырехвалентный, то есть формирует всегда четыре химических связи.[57]
1859-1860 годы
Густав Кирхгоф и Роберт Бунзен заложили основы спектроскопии для химического анализа, что позволило им открыть цезий и рубидий. Другие исследователи использовали такую же методику для исследования индия, таллия и гелия.[58]
1860 год
Станислао Каниццарро, возрождая идею Авогадро про двухатомные молекулы, составил таблицу атомных масс и представил ёё в 1860 году на химическом конгрессе в Карлсруэ, заканчивая тем самым споры последнего десятилетия про различия в атомных массах и молекулярных формулах. Это позволило Менделееву начать работу над периодической системой.[59]
1862 год
Александр Паркес на Международной выставке в Лондоне продемонстрировал паркесин — первый созданный человеком искусственный полимер. Это исследование заложило основы современной промышленности пластмасс.[60]

«Земная спираль» Шанкуртуа
1862 год
Александр Шанкуртуа создал «земную спираль» Периодической системы элементов.[61]
1864 год
Джон Ньюлендс предложил закон октав, предшественник периодического закона.[61]
1864 год
Лотар Мейер создал раннюю версию периодической системы элементов, с 28 элементами расположенными согласно валентности.[62]
1864 год
Като Гульдберг и Петер Вааге, основываясь на идеи Бертолле, предложили закон действующих масс. [63] [64] [65]
1865 год
Йоганн Лошмидт определил точное количество молекул в одном моле, которое позже было названо числом Авогадро.[66]
1865 год
Фридрих Август Кекулле, базируясь на работах Лошмидта и других, предложил структуру бензола, как кольца из шести атомом углерода с чередующимися одинарными и двойными связями.[57]
1865 год
Адольф Байер начал работу над синтезом красителя индиго: его исследования изменили методы органического синтеза и сделали переворот в производстве синтетических красителей.[67]

Первый вариант перодической системы элементов, созданный Д. И. Менделеевым
1869 год
Дмитрий Менделеев опубликовал первый вариант современной периодической таблицы элементов с 66 элементами, расположенными по порядку возрастания атомных масс. Потенциал это таблицы был с том, что она позволяла прогнозировать свойства ещё не открытых элементов.[62][61]
1873 год
Якоб Вант-Гофф и Жозеф Ле Бель, независимо друг от друга создали модель химической связи: теорию асимметрического атома углерода. Эта теория объясняла результаты экспериментов Пастера по изучению хиральности и давала физическое объяснения оптической активности хиральных соединений.[68]
1876 год
Джозайя Гиббс публикует книгу On the Equilibrium of Heterogeneous Substances, которая стала результатом его работы по изучению термодинамики и физической химии. В ней также было введено понятие свободной энергии для объяснения физических основ химического равновесия.[69]
1877 год
Людвиг Больцман предложил объяснение статистических основ многих важных физико-химических концепций, включая энтропию и распределение скоростей движения молекул в газовой фазе (см. Статистика Максвелла — Больцмана).[70]
1883 год
Аррениус, Сванте Август развил теорию существования ионов для объяснения электропроводности электролитов.[71]
1884 год
Якоб Вант-Гофф опубликовал Études de Dynamique chimique (Этюды по химической динамике) — основательный труд по химической кинетике.[72]

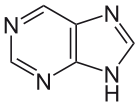
Структурная формула пурина
1884 год
Герман Фишер предлагает структуру пурина — ключевого элемента многих биомолекул, который был синтезирован в 1898 году. Также он начинает работу над химией глюкозы и подобных сахаров.[73]
1884 год
Анри Ле Шателье предложил принцип Ле Шателье, который описывает изменение химического равновесия в ответ на внешнее действие.[74]
1885 год
Евген Гольдштейн дал название катодным лучам, которые, как позже было установлено, состоят из потока электронов и анодным лучам, которые, как позже было установлено, состояли из ионов водорода, что образовались при потере атомами электронов в электронно-лучевой трубке. Позднее они были названы протонами.[75]

Альфред Вернер
1893 год
Альфред Вернер исследовал октаэдрическую структуру комплексных соединений кобальта, что положило начало химии комплексных соединений.[76]
1894-1898 годы
Уильям Рамзай открыл инертные газы, что позволило заполнить пропуски в периодической системе элементов и дало возможность развивать теории химической связи.[77]
1897 год
Джозеф Томсон открыл электрон исследуя электронно-лучевую трубку.[78]
1898 год
Вильгельм Вин показал, что анодные лучи (поток позитивно заряженных ионов) отклоняется магнитным полем и сила этого отклонения пропорциональна соотношению масса-заряд частиц в потоке. Это исследование заложило основу нового метода аналитической химии — масс-спектрометрии.[79]
1898 год
Мария Склодовская-Кюри и Пьер Кюри выделили элементы радий и полоний из минерала пехбленда.[80]
1900 год
Эрнест Резерфорд показал, что источником радиоактивного излучения является распад атомов и ввел термины для описания разных типов радиации.[81]
XX век
1903 год
Михаил Семёнович Цвет заложил основы хроматографии — важнейшего аналитического метода.[82]
1904 год
Хантаро Нагаока предложил раннюю ошибочную «планетарную модель» атома, в которой электроны по стационариным орбитам летают вокруг массивного ядра.[83]
1905 год
Фриц Габер и Карл Бош изобрели процесс Габера для получения аммиака из его составляющих. Это стало стимулом к развитию промышленной химии и повлияло на производство удобрений для сельского хозяйства.[84]
1905 год
Альберт Эйнштейн объяснил причину броуновского движения подтвердив тем самым теорию строения материи из атомов.[85]
1907 год
Лео Бакеланд изобрел бакелит, одну из первых коммерческих пластмасс.[86]
1909 год
Эрнест Резерфорд, Ганс Гейгер и Эрнест Марсден провели эксперимент, который подтвердил ядерную модель атома с небольшим, плотным, положительно заряженным ядром окруженным электронным облаком.[81]

1909 год
Роберт Милликен очень точно измерил заряд отдельных электронов в эксперименте с масляной каплей, подтвердив, что все электроны имеют одинаковый заряд и массу.[87]
1909 год
Сёрен Сёренсен создал концепцию pH и развил методы измерения кислотности.[88]
1911 год
Антониус Ван дер Брук высказал идею, что положение элемента в периодической системе обуславливается не столько его атомной массой, сколько зарядом его ядра.[89]
1911 год
Прошел первый Сольвеевский конгресс в Брюсселе на котором собрались наиболее известные ученые того времени. Конгрессы по физике и химии продолжают проводиться время от времени и сейчас.[90]
1912 год
Уильям Генри Брэгг и его сын Уильям Лоренс Брэгг предложили правило Брэгга, что привело к появлению рентгеноструктурного анализа — важного метода для определения кристаллической структуры вещества.[91]
1912 год
Петер Дебай развил концепцию про молекулярный диполь для объяснения асимметричного распределения заряда в молекулах.[92]

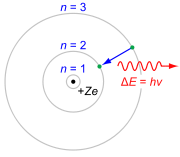
Модель атома по Бору
1913 год
Нильс Бор ввел принципы квантовой механики в описание структуры атома и предложил модель атома, к которой электроны находятся лишь на четко локализованных орбиталях.[93]
1913 год
Генри Мозли, разрабатывая идею Ван дер Брука, предложил концепцию атомного номера для разрешения проблемы с несоответствиями в периодической таблице, основанной на атомной массе.[94]
1913 год
Фредерик Содди создал концепцию изотопов, когда элементы с одинаковыми химическими свойствами имеют разные атомные массы.[95]
1913 год
Джозеф Джон Томсон развив работы Вина, показал, что заряженные частицы могут быть разделены по соотношению масса-заряд, что стало завершающей вехой появления масс-спектрометрии.[96]

Гилберт Ньютон Льюис
1916 год
Гильберт Льюис опубликовал книгу "Атом и молекула", в которой заложил основы теории валентных связей (октетная теория).[97]
1921 год
Отто Штерн и Вальтер Герлах ввели концепцию квантово-механического спина элементарных частиц.[98]
1923 год
Гильберт Льюис и Мерле Рэндалл написали книгу "Термодинамика и свободная энергия химических соединений", которая стала первым современным трактатом в области химической термодинамики.[99]
1923 год
Гильберт Льюис создал электронную теорию кислот и оснований, согласно которой кислотность и основность проявляется приемом или отдачей пары электронов.[97]
1924 год
Луи де Бройль предложил волновую модель атомной структуры, которая основывается на идеях корпускулярно-волнового дуализма.[100]
1925 год
Вольфганг Паули предложил принцип Паули, который утверждал, что два электрона не могут находиться в одном атоме в одинаковом квантовом состоянии, которое описывается четырьмя квантовыми числами.[101]
1926 год
Эрвин Шрёдингер вывел уравнение Шрёдингера, которое описывает математически волновую модель атома.[102]
1927 год
Вернер Гейзенберг разработал принцип неопределённости Гейзенберга который, вместе с другими принципами оисывает механику движения электрона вокруг ядра.[103]
1927 год
Фриц Лондон и Вальтер Хейтлер применили принципы квантовой механики для объяснения природы ковалентной связи в молекуле водорода.[104] Это событие считается рождением квантовой химии.[105]
около 1930 года
Лайнус Полинг предложил правила Полинга, кототрые стали основными принципами использования рентгеноструктурного анализа для определения структуры молекул.[106]

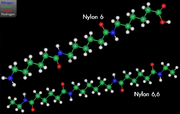
Модель двух наиболее используемых форм нейлона
1930 год
Уоллес Карозерс, возглавивший команду химиков в компании DuPont, изобрел нейлон - один из наиболее коммерчески успешных синтетических полимеров в истории.[107]
1931 год
Эрих Хюккель предложил правило Хюккеля, которое объясняет когда плоские кольцевые молекулы будут обладать ароматичностью.[108]
1931 год
Гарольд Юри открыл дейтерий с помощью фракционированной конденсации жидкого водрода.[109]
1932 год
Джеймс Чедвик открыл нейтрон.[110]
1932–1934 годы
Лайнус Полинг и Роберт Малликен оценили электронегативность различных элементов, создав шкалы электронегативности, которые носят их имена.[111]
1937 год
Карло Перье и Эмилио Сегре провели подтвержденный синтез первого искусственного элемента - технеция, заполнив этим одно из пустых мест в периодической системе. Тем не менее, существует мнение, что впервые он был синтезирован в 1925 году Вальтером Ноддаком с коллегами.[112]
1937 год
Эжен Гудри создал метод промышленного крекинга нефти, что позволило создать первый современный нефтеперерабатывающий завод.[113]
1937 год
Джон Аллен и Дон Майзнер и независимо Пётр Капица получили переохлажденный гелий: первую сверхтекучую жидкость с нулевой вязкостью. Это вещество демонстрировало квантово-механические свойства в макроскопическом масштабе.[114]
1938 год
Отто Ган открыл процесс ядерного деления в атомах урана и тория.[115]
1939 год
Лайнус Полинг написал книгу „Природа химической связи“, которая стала результатом десятилетий работы над химической связью. Книга стала одной из важнейших работ в современной химии. В ней объяснялись гибридизация атомных орбиталей, ковалентная связь и ионная связь с помощью феномена электронегативности, резонанс, который был использован для описания структуры разных веществ, в том числе и бензола.[106]
1940 год
Эдвин Макмиллан и Филипп Абельсон открыли нептуний - самый легкий и первый искусственно полученный трансурановый элемент. Он был найден в продуктах распада урана. Макмиллан основал лабораторию в Беркли, в которой в дальнейшем были открыты многие новые элементы и изотопы.[116]
1941 год
Гленн Сиборг продолжил работы Макмиллана по созданию новых атомных ядер. Он стал пионером метода нейтронного захвата и позже других типов ядерных реакций. В результате он стал первооткрывателем или участником открытия 9 новых химических элементов и большого количества новых изотопов существующих элементов.[116]
1945 год
Якоб Маринский, Лоуренс Гленденин и Чарльз Кориэлл провели первый подтвержденный синтез прометия, заполнив тем самым последнюю "дырку" в периодической таблице.[117]
1945–1946 годы
Феликс Блох и Эдвард Пёрселл создали метод ядерного магнитного резонанса, который стал важным элементом аналитической химии для определении структуры органических молекул.[118]
1951 год
Лайнус Полинг, использовав метод рентгеноструктурного анализа, определил вторичную структуру белков.[106]
1952 год
Алан Волш создал метод атомно-абсорбционной спектрометрии, который стал важным количественным спектроскопическим методом, для измерения концентрации отдельного элемента в смеси.[119]
1952 год
Роберт Вудворд, Джефри Уилкинсон и Отто Фишер исследовали структуру ферроцена, заложив этим основы металлоорганической химии.[120]
1953 год
Джеймс Уотсон и Френсис Крик предложили модель структуры ДНК, открыв дверь в новую область исследований - молекулярную биологию.[121]
1957 год
Йенс Скоу открыл Na⁺/K⁺-АТФазу - первый ион-транспортирующий фермент.[122]
1958 год
Макс Перуц и Джон Кендрю использовали рентгеновскую кристаллографию для определения белковой структуры миоглобина кашалота.[123]
1962 год
Нейл Бартлет синтезировал гексафторплатинат ксенона тем самым показав, что инертные газы таки способны образовывать химические соединения.[124]
1962 год
Джордж Ола получил карбокатионы с помощью реакции с суперксилотой.[125]
1964 год
Рихард Эрнст провел эксперименты, которые легли в основу техники ЯМР с Фурье-преобразованием. Это очень повысило чувствительность метода и позволило создать Магнитно-резонансная томография.[126]
1965 год
Роберт Вудворд и Роальд Хофман предложили правило Вудворда — Хофмана, которое используя симметрию молекулярных орбиталей, объясняет стереохимию химических реакций.[120]
1966 год
Хотоши Нозаки и Рёдзи Ноёри исследовали первый пример асимметричного катализа (гидрирование), используя хиральный комплекс переходного металла с четко определенной структурой.[127][128]
1970 год
Джон Попл создал программу GAUSSIAN, которая облегчила расчеты в вычислительной химии.[129]
1971 год
Ив Шовен предложил объяснение механизма реакции метатезиса олефинов.[130]
1975 год
Барри Шарплесс и его группа исследовали стереоселективность реакций окисления, включая эпоксидацию по Шарплессу,[131][132] ассимметрическое дигидроксилирование по Шарплессу,[133][134][135] и оксиаминирования по Шарплессу.[136][137][138]

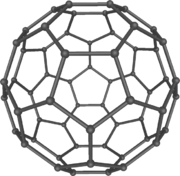
Бакминстерфуллерен, C60
1985 год
Харольд Крото, Роберт Кёрл и Смолли, Ричард открыли фуллерены - класс молекул, построенных только из углерода, которые по форме напоминают геодезический купол и названные в честь архитектора Ричард Бакминстера Фуллера.[139]
1991 год
Сумио Ииджима используя Электронный микроскоп исследовал новый тип фуллеренов, который имел вид цилиндров и получил название углеродных нанотрубок, хотя более ранние исследования в этой области были проведены в 1951 году. Нанотрубки стали важным компонентом нового раздела знаний - нанотехнологий.[140]
1994 год
Был проведен первый синтез таксола Робертом Холтоном и его коллегами.[141][142][143]
1995 год
Эрик Корнелл и Карл Виман получили первый Конденсат Бозе — Эйнштейна, субстанцию, которая демонстрировала квантово-механические свойства в макроскопическом размере.[144]
См. также
Примечания
- ↑ Hoeller, Stephan A. On the Trail of the Winged God: Hermes and Hermeticism Throughout the Ages. Gnosis: A Journal of Western Inner Traditions (Vol. 40, Summer 1996). The Gnosis Archive (1996). Архивировано из первоисточника 22 апреля 2012. Проверено 11 марта 2007.
- ↑ Giese, Patsy Ann Women in Science: 5000 Years of Obstacles and Achievements. SHiPS Resource Center for Sociology, History and Philosophy in Science Teaching. Архивировано из первоисточника 22 апреля 2012. Проверено 11 марта 2007.
- ↑ Levey Martin Early Arabic Pharmacology: An Introduction Based on Ancient and Medeval Sources. — Brill Archive. — P. 9. — ISBN 9004037969
- ↑ Parry, Richard Empedocles. Stanford Encyclopedia of Philosophy. Metaphysics Research Lab, CSLI, Stanford University (4 марта 2005). Архивировано из первоисточника 22 апреля 2012. Проверено 11 марта 2007.
- ↑ Berryman, Sylvia Leucippus. Stanford Encyclopedia of Philosophy. Metaphysics Research Lab, CSLI, Stanford University (14 августа 2004). Архивировано из первоисточника 22 апреля 2012. Проверено 11 марта 2007.
- ↑ Berryman, Sylvia Democritus. Stanford Encyclopedia of Philosophy. Metaphysics Research Lab, CSLI, Stanford University (15 августа 2004). Архивировано из первоисточника 22 апреля 2012. Проверено 11 марта 2007.
- ↑ Hillar, Marian The Problem of the Soul in Aristotle's De anima. NASA WMAP (2004). Архивировано из первоисточника 22 апреля 2012. Проверено 10 августа 2006.
- ↑ HISTORY/CHRONOLOGY OF THE ELEMENTS. Архивировано из первоисточника 22 апреля 2012. Проверено 12 марта 2007.
- ↑ 1 2 Strathern Paul Mendeleyev's Dream - The Quest for the Elements. — Berkley Books, 2000. — ISBN 0-425-18467-6
- ↑ Research Committee of Strasburg University, Imam Jafar Ibn Muhammad As-Sadiq A.S. The Great Muslim Scientist and Philosopher, translated by Kaukab Ali Mirza, 2000. Willowdale Ont. ISBN 0-9699490-1-4.
- ↑ Derewenda, Zygmunt S. (2007), "«On wine, chirality and crystallography»", Acta Crystallographica Section A: Foundations of Crystallography Т. 64: 246–258 [247], DOI 10.1107/S0108767307054293
- ↑ John Warren (2005). «War and the Cultural Heritage of Iraq: a sadly mismanaged affair», Third World Quarterly, Volume 26, Issue 4 & 5, p. 815—830.
- ↑ Dr. A. Zahoor (1997). JABIR IBN HAIYAN (Geber). University of Indonesia.
- ↑ Father of Chemistry: Jabir Ibn Haiyan. Famous Muslism. Famousmuslims.com (2003). Архивировано из первоисточника 22 апреля 2012. Проверено 12 марта 2007.
- ↑ Kraus, Paul, Jâbir ibn Hayyân, Contribution à l’histoire des idées scientifiques dans l’Islam. I. Le corpus des écrits jâbiriens. II. Jâbir et la science grecque,. Cairo (1942—1943). Repr. By Fuat Sezgin, (Natural Sciences in Islam. 67-68), Frankfurt. 2002:

“The efforts of Berthelot and Ruelle to put a little order in this mass of literature led only to poor results, and the later researchers, among them in particular Mrs. Hammer-Jensen, Tannery, Lagercrantz , von Lippmann, Reitzenstein, Ruska, Bidez, Festugiere and others, could make clear only few points of detail… 
(cf. Ahmad Y Hassan A Critical Reassessment of the Geber Problem: Part Three. Архивировано из первоисточника 22 апреля 2012. Проверено 9 августа 2008.) - ↑ Felix Klein-Frank (2001), «Al-Kindi», in Oliver Leaman & Hossein Nasr, History of Islamic Philosophy, p. 174. London: Routledge.
- ↑ Hassan, Ahmad Y Alcohol and the Distillation of Wine in Arabic Sources. History of Science and Technology in Islam. Архивировано из первоисточника 22 апреля 2012. Проверено 29 марта 2008.
- ↑ MOHAMMAD IBN ZAKARIYA AL-RAZI. Famous Muslism. Famousmuslims.com (2003). Архивировано из первоисточника 22 апреля 2012. Проверено 12 марта 2007.
- ↑ G. Stolyarov II (2002), «Rhazes: The Thinking Western Physician», The Rational Argumentator, Issue VI.
- ↑ Michael E. Marmura (1965). «An Introduction to Islamic Cosmological Doctrines. Conceptions of Nature and Methods Used for Its Study by the Ikhwan Al-Safa’an, Al-Biruni, and Ibn Sina by Seyyed Hossein Nasr», Speculum 40 (4), p. 744—746.
- ↑ Robert Briffault (1938). The Making of Humanity, p. 196—197.
- ↑ «Robert Grosseteste» in the 1913 Catholic Encyclopedia
- ↑ Farid Alakbarov (Summer 2001). A 13th-Century Darwin? Tusi’s Views on Evolution, Azerbaijan International 9 (2).
- ↑ O'Connor, J. J. Roger Bacon. MacTutor. School of Mathematics and Statistics University of St Andrews, Scotland (2003). Архивировано из первоисточника 22 апреля 2012. Проверено 12 марта 2007.
- ↑ Zdravkovski, Zoran GEBER. Institute of Chemistry, Skopje, Macedonia (9 марта 1997). Архивировано из первоисточника 22 апреля 2012. Проверено 12 марта 2007.
- ↑ FROM LIQUID TO VAPOR AND BACK: ORIGINS. Special Collections Department. University of Delaware Library. Архивировано из первоисточника 22 апреля 2012. Проверено 12 марта 2007.
- ↑ Asarnow, Herman Sir Francis Bacon: Empiricism. An Image-Oriented Introduction to Backgrounds for English Renaissance Literature. University of Portland (8 августа 2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ Sedziwój, Michal. infopoland: Poland on the Web. University at Buffalo. Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ Crosland, M.P. (1959). «The use of diagrams as chemical 'equations' in the lectures of William Cullen and Joseph Black.» Annals of Science, Vol 15, No. 2, Jun.
- ↑ «René Descartes» in the 1913 Catholic Encyclopedia
- ↑ Johann Baptista van Helmont. History of Gas Chemistry. Center for Microscale Gas Chemistry, Creighton University (25 сентября 2005). Архивировано из первоисточника 22 апреля 2012. Проверено 23 февраля 2007.
- ↑ 1 2 Robert Boyle. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ Cooper, Alan Joseph Black. History of Glasgow University Chemistry Department. University of Glasgow Department of Chemistry (1999).(недоступная ссылка — история) Проверено 23 февраля 2006.
- ↑ Partington J.R. A Short History of Chemistry. — Dover Publications, Inc, 1989. — ISBN 0-486-65977-1
- ↑ Joseph Priestley. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ Carl Wilhelm Scheele. History of Gas Chemistry. Center for Microscale Gas Chemistry, Creighton University (11 сентября 2005). Архивировано из первоисточника 22 апреля 2012. Проверено 23 февраля 2007.
- ↑ «Lavoisier, Antoine.» Encyclopædia Britannica. 2007. Encyclopædia Britannica Online. 24 July 2007 <http://www.britannica.com/eb/article-9369846>.
- ↑ 1 2 3 Weisstein, Eric W. Lavoisier, Antoine (1743-1794). Eric Weisstein's World of Scientific Biography. Wolfram Research Products (1996). Архивировано из первоисточника 22 апреля 2012. Проверено 23 февраля 2007.
- ↑ Jacques Alexandre César Charles. Centennial of Flight. U.S. Centennial of Flight Commission (2001). Архивировано из первоисточника 22 апреля 2012. Проверено 23 февраля 2007.
- ↑ Burns Ralph A. Fundamentals of Chemistry. — Prentice Hall, 1999. — P. 32. — ISBN 0023173513
- ↑ Proust, Joseph Louis (1754-1826). 100 Distinguished Chemists. European Association for Chemical and Molecular Science (2005).(недоступная ссылка — история) Проверено 23 февраля 2007.
- ↑ Inventor Alessandro Volta Biography. The Great Idea Finder. The Great Idea Finder (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 23 февраля 2007.
- ↑ 1 2 John Dalton. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ December 6 Births. Today in Science History. Today in Science History (2007). Архивировано из первоисточника 22 апреля 2012. Проверено 12 марта 2007.
- ↑ Jöns Jakob Berzelius. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ Michael Faraday. Famous Physicists and Astronomers. Архивировано из первоисточника 22 апреля 2012. Проверено 12 марта 2007.
- ↑ 1 2 3 Justus von Liebig and Friedrich Wöhler. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ William Prout. Архивировано из первоисточника 22 апреля 2012. Проверено 12 марта 2007.
- ↑ Hess, Germain Henri. Архивировано из первоисточника 22 апреля 2012. Проверено 12 марта 2007.
- ↑ Kolbe, Adolph Wilhelm Hermann. 100 Distinguished European Chemists. European Association for Chemical and Molecular Sciences (2005).(недоступная ссылка — история) Проверено 12 марта 2007.
- ↑ Weisstein, Eric W. Kelvin, Lord William Thomson (1824-1907). Eric Weisstein's World of Scientific Biography. Wolfram Research Products (1996). Архивировано из первоисточника 22 апреля 2012. Проверено 12 марта 2007.
- ↑ History of Chirality. Stheno Corporation (2006).(недоступная ссылка — история) Проверено 12 марта 2007.
- ↑ Lambert-Beer Law. Sigrist-Photometer AG (7 марта 2007). Архивировано из первоисточника 22 апреля 2012. Проверено 12 марта 2007.
- ↑ Benjamin Silliman, Jr. (1816-1885). Picture History. Picture History LLC (2003). Архивировано из первоисточника 22 апреля 2012. Проверено 24 марта 2007.
- ↑ William Henry Perkin. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 24 марта 2007.
- ↑ 1 2 Archibald Scott Couper and August Kekulé von Stradonitz. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ O'Connor, J. J. Gustav Robert Kirchhoff. MacTutor. School of Mathematics and Statistics University of St Andrews, Scotland (2002). Архивировано из первоисточника 22 апреля 2012. Проверено 24 марта 2007.
- ↑ Eric R. Scerri, The Periodic Table: Its Story and Its Significance, Oxford University Press, 2006.
- ↑ Alexander Parkes (1813 - 1890). People & Polymers. Plastics Historical Society.(недоступная ссылка — история) Проверено 24 марта 2007.
- ↑ 1 2 3 The Periodic Table. The Third Millennium Online. Архивировано из первоисточника 22 апреля 2012. Проверено 24 марта 2007.
- ↑ 1 2 Julius Lothar Meyer and Dmitri Ivanovich Mendeleev. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ C.M. Guldberg and P. Waage, «Studies Concerning Affinity» C. M. Forhandlinger: Videnskabs-Selskabet i Christiana (1864), 35
- ↑ P. Waage, «Experiments for Determining the Affinity Law» ,Forhandlinger i Videnskabs-Selskabet i Christiania, (1864) 92.
- ↑ C.M. Guldberg, «Concerning the Laws of Chemical Affinity», C. M. Forhandlinger i Videnskabs-Selskabet i Christiania (1864) 111
- ↑ «Johann Josef Loschmidt». John H. Lienhard. The Engines of Our Ingenuity. NPR. KUHF-FM Houston. 2003. Серия 1858. Transcript. Проверено 2007-03-24 .
- ↑ Adolf von Baeyer: The Nobel Prize in Chemistry 1905. Nobel Lectures, Chemistry 1901-1921. Elsevier Publishing Company (1966). Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ Jacobus Henricus van't Hoff. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ O'Connor, J. J. Josiah Willard Gibbs. MacTutor. School of Mathematics and Statistics University of St Andrews, Scotland (1997). Архивировано из первоисточника 22 апреля 2012. Проверено 24 марта 2007.
- ↑ Weisstein, Eric W. Boltzmann, Ludwig (1844-1906). Eric Weisstein's World of Scientific Biography. Wolfram Research Products (1996). Архивировано из первоисточника 22 апреля 2012. Проверено 24 марта 2007.
- ↑ Svante August Arrhenius. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ Jacobus H. van 't Hoff: The Nobel Prize in Chemistry 1901. Nobel Lectures, Chemistry 1901-1921. Elsevier Publishing Company (1966). Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ Emil Fischer: The Nobel Prize in Chemistry 1902. Nobel Lectures, Chemistry 1901-1921. Elsevier Publishing Company (1966). Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ Henry Louis Le Châtelier. World of Scientific Discovery. Thomson Gale (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 24 марта 2007.
- ↑ History of Chemistry. Intensive General Chemistry. Columbia University Department of Chemistry Undergraduate Program. Архивировано из первоисточника 22 апреля 2012. Проверено 24 марта 2007.
- ↑ Alfred Werner: The Nobel Prize in Chemistry 1913. Nobel Lectures, Chemistry 1901-1921. Elsevier Publishing Company (1966). Архивировано из первоисточника 22 апреля 2012. Проверено 24 марта 2007.
- ↑ William Ramsay: The Nobel Prize in Chemistry 1904. Nobel Lectures, Chemistry 1901-1921. Elsevier Publishing Company (1966). Архивировано из первоисточника 22 апреля 2012. Проверено 20 марта 2007.
- ↑ Joseph John Thomson. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ Alfred Werner: The Nobel Prize in Physics 1911. Nobel Lectures, Physics 1901-1921. Elsevier Publishing Company (1967). Архивировано из первоисточника 22 апреля 2012. Проверено 24 марта 2007.
- ↑ Marie Sklodowska Curie. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ 1 2 Ernest Rutherford: The Nobel Prize in Chemistry 1908. Nobel Lectures, Chemistry 1901-1921. Elsevier Publishing Company (1966). Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ Tsvet, Mikhail (Semyonovich). Compton's Desk Reference. Encyclopædia Britannica (2007). Архивировано из первоисточника 22 апреля 2012. Проверено 24 марта 2007.
- ↑ Physics Time-Line 1900 to 1949. Weburbia.com. Архивировано из первоисточника 22 апреля 2012. Проверено 25 марта 2007.
- ↑ Fritz Haber. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ Cassidy, David Einstein on Brownian Motion. The Center for History of Physics (1996). Архивировано из первоисточника 22 апреля 2012. Проверено 25 марта 2007.
- ↑ Leo Hendrik Baekeland. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ Robert A. Millikan: The Nobel Prize in Physics 1923. Nobel Lectures, Physics 1922-1941. Elsevier Publishing Company (1965). Архивировано из первоисточника 22 апреля 2012. Проверено 17 июля 2007.
- ↑ Søren Sørensen. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ Parker, David Nuclear Twins: The Discovery of the Proton and Neutron. Electron Centennial Page. Архивировано из первоисточника 22 апреля 2012. Проверено 25 марта 2007.
- ↑ Solvay Conference. Einstein Symposium (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 28 марта 2007.
- ↑ The Nobel Prize in Physics 1915. Nobelprize.org. The Nobel Foundation. Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ Peter Debye: The Nobel Prize in Chemistry 1936. Nobel Lectures, Chemistry 1922-1941. Elsevier Publishing Company (1966). Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ Niels Bohr: The Nobel Prize in Physics 1922. Nobel Lectures, Chemistry 1922-1941. Elsevier Publishing Company (1966). Архивировано из первоисточника 22 апреля 2012. Проверено 25 марта 2007.
- ↑ Weisstein, Eric W. Moseley, Henry (1887-1915). Eric Weisstein's World of Scientific Biography. Wolfram Research Products (1996). Архивировано из первоисточника 22 апреля 2012. Проверено 25 марта 2007.
- ↑ Frederick Soddy The Nobel Prize in Chemistry 1921. Nobel Lectures, Chemistry 1901-1921. Elsevier Publishing Company (1966). Архивировано из первоисточника 22 апреля 2012. Проверено 25 марта 2007.
- ↑ Early Mass Spectrometry. A History of Mass Spectrometry. Scripps Center for Mass Spectrometry (2005).(недоступная ссылка — история) Проверено 26 марта 2007.
- ↑ 1 2 Gilbert Newton Lewis and Irving Langmuir. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ Electron Spin. Архивировано из первоисточника 22 апреля 2012. Проверено 26 марта 2007.
- ↑ LeMaster, Nancy GILBERT NEWTON LEWIS: AMERICAN CHEMIST (1875-1946). Woodrow Wilson Leadership Program in Chemistry. The Woodrow Wilson National Fellowship Foundation (1992). Архивировано из первоисточника 22 апреля 2012. Проверено 25 марта 2007.
- ↑ Louis de Broglie: The Nobel Prize in Physics 1929. Nobel Lectures, Physics 1922-1941. Elsevier Publishing Company (1965). Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ Wolfgang Pauli: The Nobel Prize in Physics 1945. Nobel Lectures, Physics 1942-1962. Elsevier Publishing Company (1964). Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ Erwin Schrödinger: The Nobel Prize in Physics 1933. Nobel Lectures, Physics 1922-1941. Elsevier Publishing Company (1965). Архивировано из первоисточника 18 августа 2011. Проверено 28 февраля 2007.
- ↑ Werner Heisenberg: The Nobel Prize in Physics 1932. Nobel Lectures, Physics 1922-1941. Elsevier Publishing Company (1965). Архивировано из первоисточника 18 августа 2011. Проверено 28 февраля 2007.
- ↑ Walter Heitler and Fritz London Wechselwirkung neutraler Atome und homöopolare Bindung nach der Quantenmechanik, Zeitschrift für Physik 44 (1927) 455-472.
- ↑ Ivor Grattan-Guinness. Companion Encyclopedia of the History and Philosophy of the Mathematical Sciences. Johns Hopkins University Press, 2003, p. 1266.; Jagdish Mehra, Helmut Rechenberg. The Historical Development of Quantum Theory. Springer, 2001, p. 540.
- ↑ 1 2 3 Linus Pauling: The Nobel Prize in Chemistry 1954. Nobel Lectures, Chemistry 1942-1962. Elsevier Publishing Company (1964). Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ Wallace Hume Carothers. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ Rzepa, Henry S. The aromaticity of Pericyclic reaction transition states. Department of Chemistry, Imperial College London. Архивировано из первоисточника 22 апреля 2012. Проверено 26 марта 2007.
- ↑ Harold C. Urey: The Nobel Prize in Chemistry 1934. Nobel Lectures, Chemistry 1922-1941. Elsevier Publishing Company (1965). Архивировано из первоисточника 22 апреля 2012. Проверено 26 марта 2007.
- ↑ James Chadwick: The Nobel Prize in Physics 1935. Nobel Lectures, Physics 1922-1941. Elsevier Publishing Company (1965). Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ William B. Jensen (2003). «Electronegativity from Avogadro to Pauling: II. Late Nineteenth- and Early Twentieth-Century Developments». Journal of Chemical Education 80: 279.
- ↑ Emilio Segrè: The Nobel Prize in Physics 1959. Nobel Lectures, Physics 1942–1962. Elsevier Publishing Company (1965). Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ Eugene Houdry. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ Pyotr Kapitsa: The Nobel Prize in Physics 1978. Les Prix Nobel, The Nobel Prizes 1991. Nobel Foundation (1979). Архивировано из первоисточника 22 апреля 2012. Проверено 26 марта 2007.
- ↑ Otto Hahn: The Nobel Prize in Chemistry 1944. Nobel Lectures, Chemistry 1942–1962. Elsevier Publishing Company (1964). Архивировано из первоисточника 22 апреля 2012. Проверено 7 апреля 2007.
- ↑ 1 2 Glenn Theodore Seaborg. Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation (2005). Архивировано из первоисточника 22 апреля 2012. Проверено 22 февраля 2007.
- ↑ History of the Elements of the Periodic Table. AUS-e-TUTE. Архивировано из первоисточника 22 апреля 2012. Проверено 26 марта 2007.
- ↑ The Nobel Prize in Physics 1952. Nobelprize.org. The Nobel Foundation. Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ Hannaford, Peter Alan Walsh 1916–1998. AAS Biographical Memoirs. Australian Academy of Science.(недоступная ссылка — история) Проверено 26 марта 2007.
- ↑ 1 2 Cornforth, Lord Todd, John (November 1981). «Robert Burns Woodward. 10 April 1917-8 July 1979». Biographical Memoirs of Fellows of the Royal Society (JSTOR) 27 (Nov., 1981): pp. 628–695. DOI:10.1098/rsbm.1981.0025. Проверено 2007-03-27. note: authorization required for web access.
- ↑ The Nobel Prize in Medicine 1962. Nobelprize.org. The Nobel Foundation. Архивировано из первоисточника 7 февраля 2012. Проверено 28 февраля 2007.
- ↑ Skou J (1957). «The influence of some cations on an adenosine triphosphatase from peripheral nerves.». Biochim Biophys Acta 23 (2): 394–401. DOI:10.1016/0006-3002(57)90343-8. PMID 13412736.
- ↑ The Nobel Prize in Chemistry 1962. Nobelprize.org. The Nobel Foundation. Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ Simple experiment. National historic chemical landmarks. American Chemical Society. Архивировано из первоисточника 22 апреля 2012. Проверено 2 марта 2007.; Raber, L. Noble Gas Reactivity Research Honored. Chemical and Engineering News, July 3, 2006, Volume 84, Number 27, p. 43
- ↑ G. A. Olah, S. J. Kuhn, W. S. Tolgyesi, E. B. Baker, J. Am. Chem. Soc. 1962, 84, 2733; G. A. Olah, lieu. Chim. (Buchrest), 1962, 7, 1139 (Nenitzescu issue); G. A. Olah, W. S. Tolgyesi, S. J. Kuhn, M. E. Moffatt, I. J. Bastien, E. B. Baker, J. Am. Chem. Soc. 1963, 85, 1328.
- ↑ Richard R. Ernst The Nobel Prize in Chemistry 1991. Les Prix Nobel, The Nobel Prizes 1991. Nobel Foundation (1992). Архивировано из первоисточника 22 апреля 2012. Проверено 27 марта 2007.
- ↑ H. Nozaki, S. Moriuti, H. Takaya, R. Noyori, Tetrahedron Lett. 1966, 5239;
- ↑ H. Nozaki, H. Takaya, S. Moriuti, R. Noyori, Tetrahedron 1968, 24, 3655.
- ↑ W. J. Hehre, W. A. Lathan, R. Ditchfield, M. D. Newton, and J. A. Pople, Gaussian 70 (Quantum Chemistry Program Exchange, Program No. 237, 1970).
- ↑ Catalyse de transformation des oléfines par les complexes du tungstène. II. Télomérisation des oléfines cycliques en présence d'oléfines acycliques Die Makromolekulare Chemie Volume 141, Issue 1, Date: 9 February 1971, Pages: 161–176 Par Jean-Louis Hérisson, Yves Chauvin DOI:10.1002/macp.1971.021410112
- ↑ Katsuki, T.; Sharpless, K. B. J. Am. Chem. Soc. 1980, 102, 5974. (DOI:10.1021/ja00538a077)
- ↑ Hill, J. G.; Sharpless, K. B.; Exon, C. M.; Regenye, R. Org. Syn., Coll. Vol. 7, p.461 (1990); Vol. 63, p.66 (1985). (Article)
- ↑ Jacobsen, E. N.; Marko, I.; Mungall, W. S.; Schroeder, G.; Sharpless, K. B. J. Am. Chem. Soc. 1988, 110, 1968. (DOI:10.1021/ja00214a053)
- ↑ Kolb, H. C.; Van Nieuwenhze, M. S.; Sharpless, K. B. Chem. Rev. 1994, 94, 2483–2547. (Review) (DOI:10.1021/cr00032a009)
- ↑ Gonzalez, J.; Aurigemma, C.; Truesdale, L. Org. Syn., Coll. Vol. 10, p.603 (2004); Vol. 79, p.93 (2002). (Article)
- ↑ Sharpless, K. B.; Patrick, D. W.; Truesdale, L. K.; Biller, S. A. J. Am. Chem. Soc. 1975, 97, 2305. (DOI:10.1021/ja00841a071)
- ↑ Herranz, E.; Biller, S. A.; Sharpless, K. B. J. Am. Chem. Soc. 1978, 100, 3596–3598. (DOI:10.1021/ja00479a051)
- ↑ Herranz, E.; Sharpless, K. B. Org. Syn., Coll. Vol. 7, p.375 (1990); Vol. 61, p.85 (1983). (Article)
- ↑ The Nobel Prize in Chemistry 1996. Nobelprize.org. The Nobel Foundation. Архивировано из первоисточника 22 апреля 2012. Проверено 28 февраля 2007.
- ↑ Benjamin Franklin Medal awarded to Dr. Sumio Iijima, Director of the Research Center for Advanced Carbon Materials, AIST. National Institute of Advanced Industrial Science and Technology (2002). Архивировано из первоисточника 22 апреля 2012. Проверено 27 марта 2007.
- ↑ First total synthesis of taxol 1. Functionalization of the B ring Robert A. Holton, Carmen Somoza, Hyeong Baik Kim, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, et al.; J. Am. Chem. Soc.; 1994; 116(4); 1597–1598. DOI Abstract
- ↑ First total synthesis of taxol. 2. Completion of the C and D rings Robert A. Holton, Hyeong Baik Kim, Carmen Somoza, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, and et al. J. Am. Chem. Soc.; 1994; 116(4) pp 1599–1600 DOI Abstract
- ↑ A synthesis of taxusin Robert A. Holton, R. R. Juo, Hyeong B. Kim, Andrew D. Williams, Shinya Harusawa, Richard E. Lowenthal, Sadamu Yogai J. Am. Chem. Soc.; 1988; 110(19); 6558–6560. Abstract
- ↑ Cornell and Wieman Share 2001 Nobel Prize in Physics. NIST News Release. National Institute of Standards and Technology (2001). Архивировано из первоисточника 22 апреля 2012. Проверено 27 марта 2007.