Уран (элемент) | это... Что такое Уран (элемент)? (original) (raw)
У этого термина существуют и другие значения, см. Уран.
92 Протактиний ← Уран → Нептуний  92U 92U   |
|
|---|---|
| Внешний вид простого вещества | |
 Тяжёлый, серебристо-белый глянцеватый металл Тяжёлый, серебристо-белый глянцеватый металл |
|
| Свойства атома | |
| Имя, символ, номер | Ура́н / Uranium (U), 92 |
| Атомная масса(молярная масса) | 238,0289 а. е. м. (г/моль) |
| Электронная конфигурация | [Rn] 5f3 6d1 7s2 |
| Радиус атома | 138 пм |
| Химические свойства | |
| Ковалентный радиус | 142 пм |
| Радиус иона | (+6e) 80 (+4e) 97 пм |
| Электроотрицательность | 1,38 (шкала Полинга) |
| Электродный потенциал | U←U4+ -1,38ВU←U3+ -1,66ВU←U2+ -0,1В |
| Степени окисления | 6, 5, 4, 3 |
| Энергия ионизации(первый электрон) | 686,4(7,11) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 19,05 г/см³ |
| Температура плавления | 1405,5 K |
| Температура кипения | 4018 K |
| Теплота плавления | 12,6 кДж/моль |
| Теплота испарения | 417 кДж/моль |
| Молярная теплоёмкость | 27,67[1] Дж/(K·моль) |
| Молярный объём | 12,5 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | a=2,854 b=5,870 c=4,955[2] Å |
| Прочие характеристики | |
| Теплопроводность | (300 K) 27,5 Вт/(м·К) |
Ура́н ( ура́ний[3]) — химический элемент с атомным номером 92 в периодической системе, атомная масса 238,029; обозначается символом U (лат. Uranium), относится к семейству актиноидов.
Содержание
- 1 История
- 2 Нахождение в природе
- 3 Изотопы
- 4 Получение
- 5 Физические свойства
- 6 Химические свойства[16][17]
- 7 Применение
- 8 Физиологическое действие
- 9 Разведанные запасы урана в мире
- 10 Добыча урана в мире
- 11 Стоимость
- 12 См. также
- 13 Ссылки
- 14 Примечания
История
Ещё в древнейшие времена (I век до нашей эры) природная окись урана использовалась для изготовления жёлтой глазури для керамики. Первая важная дата в истории урана — 1789 год, когда немецкий натурфилософ и химик Мартин Генрих Клапрот восстановил извлечённую из саксонской смоляной руды золотисто-жёлтую «землю» до чёрного металлоподобного вещества. В честь самой далёкой из известных тогда планет (открытой Гершелем восемью годами раньше) Клапрот, считая новое вещество элементом, назвал его ураном (этим он хотел поддержать предложение Иоганна Боде назвать новую планету «Уран» вместо «Звезда Георга», как предложил Гершель). Пятьдесят лет уран Клапрота числился металлом. Только в 1841 г. французский химик Эжен Мелькиор Пелиго (англ.) (1811—1890)) доказал, что, несмотря на характерный металлический блеск, уран Клапрота не элемент, а оксид UO2. В 1840 г. Пелиго удалось получить настоящий уран — тяжёлый металл серо-стального цвета — и определить его атомный вес. Следующий важный шаг в изучении урана сделал в 1874 г. Д. И. Менделеев. Опираясь на разработанную им периодическую систему, он поместил уран в самой дальней клетке своей таблицы. Прежде атомный вес урана считали равным 120. Великий химик удвоил это значение. Через 12 лет предвидение Менделеева было подтверждено опытами немецкого химика Циммермана.
В 1896 г., исследуя уран, французский химик Антуан Анри Беккерель случайно открыл лучи Беккереля, которые позже Мария Кюри переименовала в радиоактивность. В это же время французскому химику Анри Муассану удалось разработать способ получения чистого металлического урана. В 1899 г. Резерфорд обнаружил, что излучение урановых препаратов неоднородно, что есть два вида излучения — альфа- и бета-лучи. Они несут различный электрический заряд; далеко не одинаковы их пробег в веществе и ионизирующая способность. Чуть позже, в мае 1900 г., Поль Вийар открыл третий вид излучения — гамма-лучи.
Эрнест Резерфорд провёл в 1907 г. первые опыты по определению возраста минералов при изучении радиоактивных урана и тория [4] на основе созданной им совместно с Фредериком Содди (Soddy, Frederick, 1877—1956; Нобелевская премия по химии, 1921) теории радиоактивности. В 1913 г. Ф. Содди ввёл понятие об изотопах (от др.-греч. ἴσος — «равный», «одинаковый», и τόπος — «место»), а в 1920 г. предсказал, что изотопы можно использовать для определения геологического возраста горных пород. В 1928 г. Ниггот реализовал, а в 1939 г. A. O. К. Нир (Nier, Alfred Otto Carl, 1911—1994) создал первые уравнения для расчёта возраста и применил масс-спектрометр для разделения изотопов.

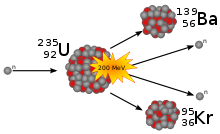
Схема деления 235U
В 1938 немецкие физики Отто Ган и Фриц Штрассман открыли непредсказанное явление, происходящее с ядром урана при облучении его нейтронами. Захватывая свободный нейтрон, ядро изотопа урана 235U делится, при этом выделяется (в расчёте на одно ядро урана) достаточно большая энергия, в основном, за счёт кинетической энергии осколков и излучения. Позднее теория этого явления была обоснована Лизой Мейтнер и Отто Фришем. Данное открытие явилось истоком как мирного, так и военного использования внутриатомной энергии.
В 1939—1940 гг. Ю. Б. Харитон и Я. Б. Зельдович впервые теоретически показали, что при небольшом обогащении природного урана ураном-235 можно создать условия для непрерывного деления атомных ядер, то есть придать процессу цепной характер.
Нахождение в природе

Уранинитовая руда
Уран широко распространён в природе. Кларк урана составляет 0,0003 % (вес.), концентрация в морской воде 3 мкг/л. Количество урана в слое литосферы толщиной 20 км оценивается в 1,3·1014 т.
Основная масса урана находится в кислых породах с высоким содержанием кремния. Значительная масса урана сконцентрирована в осадочных породах, особенно богатых органикой. В больших количествах как примесь уран присутствует в ториевых и редкоземельных минералах (ортит, сфен CaTiO3[SiO4], монацит (La,Ce)PO4, циркон ZrSiO4, ксенотим YPO4 и др.). Важнейшими урановыми рудами являются настуран (урановая смолка), уранинит и карнотит. Основными минералами — спутниками урана являются молибденит MoS2, галенит PbS, кварц SiO2, кальцит CaCO3, гидромусковит и др.
| Минерал | Основной состав минерала | Содержание урана, % |
|---|---|---|
| Уранинит | UO2, UO3 + ThO2, CeO2 | 65-74 |
| Карнотит | K2(UO2)2(VO4)2·2H2O | ~50 |
| Казолит | PbO2·UO3·SiO2·H2O | ~40 |
| Самарскит | (Y, Er, Ce, U, Ca, Fe, Pb, Th)·(Nb, Ta, Ti, Sn)2O6 | 3.15-14 |
| Браннерит | (U, Ca, Fe, Y, Th)3Ti5O15 | 40 |
| Тюямунит | CaO·2UO3·V2O5·nH2O | 50-60 |
| Цейнерит | Cu(UO2)2(AsO4)2·nH2O | 50-53 |
| Отенит | Ca(UO2)2(PO4)2·nH2O | ~50 |
| Шрекингерит | Ca3NaUO2(CO3)3SO4(OH)·9H2O | 25 |
| Уранофан | CaO·UO2·2SiO2·6H2O | ~57 |
| Фергюсонит | (Y, Ce)(Fe, U)(Nb, Ta)O4 | 0.2-8 |
| Торбернит | Cu(UO2)2(PO4)2·nH2O | ~50 |
| Коффинит | U(SiO4)(OH)4 | ~50 |
Основными формами нахождений урана в природе являются уранинит, настуран (урановая смолка) и урановые черни. Они отличаются только формами нахождения; имеется возрастная зависимость: уранинит присутствует преимущественно в древних (докембрийских породах), настуран — вулканогенный и гидротермальный — преимущественно в палеозойских и более молодых высоко- и среднетемпературных образованиях; урановые черни — в основном в молодых — кайнозойских и моложе образованиях — преимущественно в низкотемпературных осадочных породах.
Месторождения
Содержание урана в земной коре составляет 0,0003 %, он встречается в поверхностном слое земли в виде четырёх разновидностей отложений. Во-первых, это жилы уранинита, или урановой смолки (диоксид урана UO2), очень богатые ураном, но редко встречающиеся. Им сопутствуют отложения радия, так как радий является прямым продуктом изотопного распада урана. Такие жилы встречаются в Демократической Республике Конго, Канаде (Большое Медвежье озеро), Чехии и Франции. Вторым источником урана являются конгломераты ториевой и урановой руды совместно с рудами других важных минералов. Конгломераты обычно содержат достаточные для извлечения количества золота и серебра, а сопутствующими элементами становятся уран и торий. Большие месторождения этих руд находятся в Канаде, ЮАР, России и Австралии. Третьим источником урана являются осадочные породы и песчаники, богатые минералом карнотитом (уранил-ванадат калия), который содержит, кроме урана, значительное количество ванадия и других элементов. Такие руды встречаются в западных штатах США. Железоурановые сланцы и фосфатные руды составляют четвёртый источник отложений. Богатые отложения обнаружены в глинистых сланцах Швеции. Некоторые фосфатные руды Марокко и США содержат значительные количества урана, а фосфатные залежи в Анголе и Центральноафриканской Республике ещё более богаты ураном. Большинство лигнитов и некоторые угли обычно содержат примеси урана. Богатые ураном отложения лигнитов обнаружены в Северной и Южной Дакоте (США) и битумных углях Испании и Чехии[4].
В слое литосферы толщиной 20 км содержится ~ 1014 т, в морской воде 109—1010 т. Россия по запасам урана, с учетом резервных месторождений, занимает третье место в мире (после Австралии и Казахстана). В месторождениях России содержится почти 550 тыс.т запасов урана, или немногим менее 10 % его мировых запасов; около 63 % их сосредоточено в Республике Саха (Якутия). Основными месторождениями урана в России являются: Стрельцовское, Октябрьское, Антей, Мало-Тулукуевское, Аргунское молибден-урановые в вулканитах (Читинская область), Далматовское урановое в песчаниках (Курганская область), Хиагдинское урановое в песчаниках (Республика Бурятия), Южное золото-урановое в метасоматитах и Северное урановое в метасоматитах (Республика Якутия)[5]. Кроме того, выявлено и оценено множество более мелких урановых месторождений и рудопроявлений[6].
Изотопы
Радиоактивные свойства некоторых изотопов урана (выделены природные изотопы)[7]:
| Массовое число | Период полураспада | Основной тип распада |
|---|---|---|
| 233 | 1,59·105 лет | α |
| 234 | 2,45·105 лет | α |
| 235 | 7,13·108 лет | α |
| 236 | 2,39·107 лет | α |
| 237 | 6,75 сут. | β− |
| 238 | 4,47·109 лет | α |
| 239 | 23,54 мин. | β− |
| 240 | 14 час. | β− |
Природный уран состоит из смеси трёх изотопов: 238U (изотопная распространённость 99,2745 %, период полураспада _T_1/2 = 4,468·109 лет), 235U (0,7200 %, _T_1/2 = 7,04·108 лет) и 234U (0,0055 %, _T_1/2 = 2,455·105 лет)[8]. Последний изотоп является не первичным, а радиогенным, он входит в состав радиоактивного ряда 238U.[9]
Радиоактивность природного урана обусловлена в основном изотопами 238U и его дочерним нуклидом 234U. В равновесии их удельные активности равны. Удельная активность изотопа 235U в природном уране в 21 раз меньше активности 238U.
На данный момент известно 23 искусственных радиоактивных изотопа урана с массовыми числами от 217 до 242. Наиболее важный из них — 233U (_T_1/2 = 1,59·105лет) получается при облучении тория-232 нейтронами и способен к делению под воздействием тепловых нейтронов, что делает его перспективным топливом для ядерных реакторов. Наиболее долгоживущим из изотопов урана, не встречающихся в природе, является 236U с периодом полураспада 2,39·107 лет.
Изотопы урана 238U и 235U являются родоначальниками двух радиоактивных рядов. Конечными элементами этих рядов являются изотопы свинца 206Pb и 207Pb.
В природных условиях распространены в основном изотопы 234U, 235U и 238U с относительным содержанием 234U : 235U : 238U = 0,0054 : 0,711 : 99,283. Почти половина радиоактивности природного урана обусловлена изотопом 234U, который, как уже отмечено, образуется в ходе распада 238U. Для отношения содержаний 235U : 238U в отличие от других пар изотопов и независимо от высокой миграционной способности урана характерно географическое постоянство: 235U/238U = 137,88. Величина этого отношения в природных образованиях не зависит от их возраста. Многочисленные натурные измерения показали его незначительные колебания. Так в роллах величина этого отношения относительно эталона изменяется в пределах 0,9959—1,0042[10], в солях — 0,996—1,005[11]. В урансодержащих минералах (настуран, урановая чернь, циртолит, редкоземельные руды) величина этого отношения колеблется в пределах 137,30 — 138,51; причём различие между формами UIV и UVI не установлено[12]; в сфене — 138,4[13]. В отдельных метеоритах выявлен недостаток изотопа 235U. Наименьшая его концентрация в земных условиях найдена в 1972 г. французским исследователем Бужигесом в местечке Окло в Африке (месторождение в Габоне). Так, в природном уране содержится 0,720 % урана 235U, тогда как в Окло оно уменьшается до 0,557 %[14]. Это послужило подтверждением гипотезы о существовании природного ядерного реактора, который стал причиной выгорания изотопа 235U. Гипотеза была высказана Джорджем Ветриллом (George W. Wetherill) из Калифорнийского университета в Лос-Анджелесе, Марком Ингрэмом (Mark G. Inghram) из Чикагского университета и Полом Курода (Paul K. Kuroda), химиком из Университета Арканзаса, ещё в 1956 г. описавшим процесс[15]. Кроме этого, в этих же округах найдены природные ядерные реакторы: Окелобондо, Бангомбе (Bangombe) и др. В настоящее время известно 17 природных ядерных реакторов.
Получение
Самая первая стадия уранового производства — концентрирование. Породу дробят и смешивают с водой. Тяжёлые компоненты взвеси осаждаются быстрее. Если порода содержит первичные минералы урана, то они осаждаются быстро: это тяжёлые минералы. Вторичные минералы урана легче, в этом случае раньше оседает тяжёлая пустая порода. (Впрочем, далеко не всегда она действительно пустая; в ней могут быть многие полезные элементы, в том числе и уран).
Следующая стадия — выщелачивание концентратов, перевод урана в раствор. Применяют кислотное и щелочное выщелачивание. Первое — дешевле, поскольку для извлечения урана используют серную кислоту. Но если в исходном сырье, как, например, в урановой смолке, уран находится в четырёхвалентном состоянии, то этот способ неприменим: четырёхвалентный уран в серной кислоте практически не растворяется. В этом случае нужно либо прибегнуть к щелочному выщелачиванию, либо предварительно окислять уран до шестивалентного состояния.
Не применяют кислотное выщелачивание и в тех случаях, если урановый концентрат содержит доломит или магнезит, реагирующие с серной кислотой. В этих случаях пользуются едким натром (гидроксидом натрия).
Проблему выщелачивания урана из руд решает кислородная продувка. В нагретую до 150 °C смесь урановой руды с сульфидными минералами подают поток кислорода. При этом из сернистых минералов образуется серная кислота, которая и вымывает уран.
На следующем этапе из полученного раствора нужно избирательно выделить уран. Современные методы — экстракция и ионный обмен — позволяют решить эту проблему.
Раствор содержит не только уран, но и другие катионы. Некоторые из них в определённых условиях ведут себя так же, как уран: экстрагируются теми же органическими растворителями, оседают на тех же ионообменных смолах, выпадают в осадок при тех же условиях. Поэтому для селективного выделения урана приходится использовать многие окислительно-восстановительные реакции, чтобы на каждой стадии избавляться от того или иного нежелательного попутчика. На современных ионообменных смолах уран выделяется весьма селективно.
Методы ионного обмена и экстракции хороши ещё и тем, что позволяют достаточно полно извлекать уран из бедных растворов (содержание урана — десятые доли грамма на литр).
После этих операций уран переводят в твёрдое состояние — в один из оксидов или в тетрафторид UF4. Но этот уран ещё надо очистить от примесей с большим сечением захвата тепловых нейтронов — бора, кадмия, гафния. Их содержание в конечном продукте не должно превышать стотысячных и миллионных долей процента. Для удаления этих примесей технически чистое соединение урана растворяют в азотной кислоте. При этом образуется уранилнитрат UO2(NO3)2, который при экстракции трибутил-фосфатом и некоторыми другими веществами дополнительно очищается до нужных кондиций. Затем это вещество кристаллизуют (или осаждают пероксид UO4·2H2O) и начинают осторожно прокаливать. В результате этой операции образуется трёхокись урана UO3, которую восстанавливают водородом до UO2.
На диоксид урана UO2 при температуре от 430 до 600 °C воздействуют газообразным фтористым водородом для получения тетрафторида UF4. Из этого соединения восстанавливают металлический уран с помощью кальция или магния.
Физические свойства
Уран — очень тяжёлый, серебристо-белый глянцеватый металл. В чистом виде он немного мягче стали, ковкий, гибкий, обладает небольшими парамагнитными свойствами. Уран имеет три аллотропные формы:  (призматическая, стабильна до 667,7 °C),
(призматическая, стабильна до 667,7 °C),  (четырёхугольная, стабильна от 667,7 °C до 774,8 °C),
(четырёхугольная, стабильна от 667,7 °C до 774,8 °C),  (с объёмно центрированной кубической структурой, существующей от 774,8 °C до точки плавления).
(с объёмно центрированной кубической структурой, существующей от 774,8 °C до точки плавления).
Химические свойства[16][17]
Характерные степени окисления
Уран может проявлять степени окисления от +3 до +6.
| Степень окисления | Оксид | Гидроксид | Характер | Форма | Примечание |
|---|---|---|---|---|---|
| +3 | Не существует | Не существует | -- | U3+, UH3 | Сильный восстановитель |
| +4 | UO2 | Не существует | Основный | UO2, галогениды | |
| +5 | Не существует | Не существует | -- | Галогениды | В воде диспропорционирует |
| +6 | UO3 | UO2(OH)2 | Амфотерный | UO22+ (уранил)UO42- (уранат)U2O72- (диуранат) | Устойчив на воздухе и в воде |
Кроме того, существует оксид U3O8. Степень окисления в нём формально дробная, а реально он представляет собой смешанный оксид урана (V) и (VI).
Нетрудно видеть, что по набору степеней окисления и характерных соединений уран близок к элементам VIB подгруппы (хрому, молибдену, вольфраму). Из-за этого его длительное время относили к этой подгруппе („размывание периодичности“).
Свойства простого вещества
Химически уран весьма активен. Он быстро окисляется на воздухе и покрывается радужной пленкой оксида. Мелкий порошок урана самовоспламеняется на воздухе, он зажигается при температуре 150—175 °C, образуя U3O8. Реакции металлического урана с другими неметаллами приведены в таблице.
| Неметалл | Условия | Продукт |
|---|---|---|
| F2 | 20oC, бурно | UF6 |
| Cl2 | 180oC для измельченного500—600oC для компактного | Смесь UCl4, UCl5, UCl6 |
| Br2 | 650oC, спокойно | UBr4 |
| I2 | 350oC, спокойно | UI3, UI4 |
| S | 250-300oC спокойно500oC горит | US2, U2S3 |
| Se | 250-300oC спокойно500oC горит | USe2, U2Se3 |
| N2 | 450-700oCто же под давлением N1300o | UN1.75UN2UN |
| P | 600-1000oC | U3P4 |
| C | 800-1200oC | UC, UC2 |
Вода способна разъедать металл, медленно при низкой температуре, и быстро при высокой, а также при мелком измельчении порошка урана:

В кислотах-неокислителях уран растворяется, образуя UO2 или соли U4+ (при этом выделяется водород). С кислотами-окислителями (азотной, концентрированной серной) уран образует соответствующие соли уранила UO22+
С растворами щелочей уран не взаимодействует.
При сильном встряхивании металлические частицы урана начинают светиться.
Соединения урана III
Соли урана(+3) (преимущественно, галогениды) — восстановители. На воздухе при комнатной температуре они обычно устойчивы, однако при нагревании окисляются до смеси продуктов. Хлор окисляет их до UCl4 Образуют неустойчивые растворы красного цвета, в которых проявляют сильные восстановительные свойства:

Галогениды урана III образуются при восстановлении галогенидов урана (IV) водородом:
 (550—590оC)
(550—590оC)
или иодоводородом:
 (500оC)
(500оC)
а также при действии галогеноводорода на гидрид урана UH3.
Кроме того, существует гидрид урана (III) UH3. Его можно получить, нагревая порошок урана в водороде при температурах до 225оС, а выше 350оС он разлагается. Большую часть его реакций (например, реакцию с парами воды и кислотами) можно формально рассматривать как реакцию разложения с последующей реакцией металлического урана:


Соединения урана IV
Уран (+4) образует легко растворимые в воде соли зеленого цвета. Они легко окисляются до урана (+6)
Соединения урана V
Соединения урана(+5) неустойчивы и легко диспропорционируют в водном растворе:

Хлорид урана V при стоянии частично диспропорционирует:

а частично отщепляет хлор:

Соединения урана VI
Степени окисления +6 соответствует оксид UO3. В кислотах он растворяется с образованием соединений катиона уранила UO22+:

C основаниями UO3 (аналогично CrO3, MoO3 и WO3) образует различные уранат-анионы (в первую очередь, диуранат U2O72-). Последние, однако, чаще получают действием оснований на соли уранила:

Из соединений урана (+6), не содержащих кислород, известны только гексахлорид UCl6 и фторид UF6. Последний играет важнейшую роль в разделении изотопов урана.
Соединения урана (+6) наиболее устойчивы на воздухе и в водных растворах.
Ураниловые соли, такие как уранилхлорид, распадаются на ярком свету или в присутствии органических соединений.
Уран также образует ураноорганические соединения.
Применение
Ядерное топливо
Наибольшее применение имеет изотоп урана 235U, в котором возможна самоподдерживающаяся цепная ядерная реакция. Поэтому этот изотоп используется как топливо в ядерных реакторах, а также в ядерном оружии. Выделение изотопа U235 из природного урана — сложная технологическая проблема (см. разделение изотопов).
Приведем некоторые цифры для реактора мощностью 1000 МВт, работающего с нагрузкой в 80 %, и вырабатывающего 7000 ГВт·ч в год. Работа одного такого реактора в течение года требует 20 тонн уранового топлива с содержанием 3.5% U-235, который получают после обогащения примерно 153 тонн естественного урана.
Изотоп U238 способен делиться под влиянием бомбардировки высокоэнергетическими нейтронами, эту его особенность используют для увеличения мощности термоядерного оружия (используются нейтроны, порождённые термоядерной реакцией).
В результате захвата нейтрона с последующим β-распадом 238U может превращаться в 239Pu, который затем используется как ядерное топливо.
Уран-233, искусственно получаемый в реакторах из тория (торий-232 захватывает нейтрон и превращается в торий-233, который распадается в протактиний-233 и затем в уран-233), может в будущем стать распространённым ядерным топливом для атомных электростанций (уже сейчас существуют реакторы, использующие этот нуклид в качестве топлива, например KAMINI в Индии) и производства атомных бомб (критическая масса около 16 кг).
Уран-233 также является наиболее перспективным топливом для газофазных ядерных ракетных двигателей.
Тепловыделяющая способность урана
1 тонна обогащенного урана по тепловыделяющей способности равна 1 миллиону 350 тысячам тонн нефти или природного газа.
Геология
Основное применение урана в геологии — определение возраста минералов и горных пород с целью выяснения последовательности протекания геологических процессов. Этим занимается геохронология. Существенное значение имеет также решение задачи о смешении и источниках вещества.
В основе решения задачи лежат уравнения радиоактивного распада:


где 238Uo, 235Uo — современные концентрации изотопов урана;  ;
;  —_постоянные распада_ атомов соответственно урана 238U и 235U.
—_постоянные распада_ атомов соответственно урана 238U и 235U.
Весьма важным является их комбинация:
 .
.
Здесь

В связи с тем, что горные породы содержат различные концентрации урана, они обладают различной радиоактивностью. Это свойство используется при выделении горных пород геофизическими методами. Наиболее широко этот метод применяется в нефтяной геологии при геофизических исследованиях скважин, в этот комплекс входит, в частности, γ — каротаж или нейтронный гамма-каротаж, гамма-гамма-каротаж и т. д.[18]. С их помощью происходит выделение коллекторов и флюидоупоров[19].
Другие сферы применения
- Небольшая добавка урана придаёт красивую жёлто-зелёную флуоресценцию стеклу (см. Урановое стекло)[20].
- Уранат натрия Na2U2O7 использовался как жёлтый пигмент в живописи[20].
- Соединения урана применялись как краски для живописи по фарфору и для керамических глазурей и эмалей (окрашивают в цвета: жёлтый, бурый, зелёный и чёрный, в зависимости от степени окисления)[20].
- Некоторые соединения урана светочувствительны[20].
- В начале XX века уранилнитрат широко применялся для усиления негативов и окрашивания (тонирования) позитивов (фотографических отпечатков) в бурый цвет[20].
- Карбид урана-235 в сплаве с карбидом ниобия и карбидом циркония применяется в качестве топлива для ядерных реактивных двигателей (рабочее тело — водород + гексан).
- Сплавы железа и обеднённого урана (уран-238) применяются как мощные магнитострикционные материалы.
Обеднённый уран
После извлечения 235U и 234U из природного урана, оставшийся материал (уран-238) носит название «обеднённый уран», так как он обеднён 235-м изотопом. По некоторым данным, в США хранится около 560 000 тонн обеднённого гексафторида урана (UF6).
Обеднённый уран в два раза менее радиоактивен, чем природный уран, в основном за счёт удаления из него 234U. Из-за того, что основное использование урана — производство энергии, обеднённый уран — малополезный продукт с низкой экономической ценностью.
В основном его использование связано с большой плотностью урана и относительно низкой его стоимостью. Обеднённый уран используется для радиационной защиты (как это ни странно), — используется чрезвычайно высокое сечение захвата, и как балластная масса в аэрокосмических применениях, таких как рулевые поверхности летательных аппаратов. В каждом самолёте «Боинг-747» содержится 1500 кг обеднённого урана для этих целей. Ещё этот материал применяется в высокоскоростных роторах гироскопов, больших маховиках, как балласт в космических спускаемых аппаратах и гоночных яхтах, болидах формулы-1, при бурении нефтяных скважин.
Сердечники бронебойных снарядов

Сердечник (вкладыш) снаряда калибра 30 мм (пушки GAU-8 самолёта A-10) диаметром около 20 мм из обеднённого урана.
Самое известное применение обеднённого урана — в качестве сердечников для бронебойных снарядов. Большая плотность (в три раза тяжелее стали), делает закалённую урановую болванку чрезвычайно эффективным средством для пробивания брони, аналогичным по эффективности более дорогому и ненамного более тяжёлому вольфраму. Тяжёлый урановый наконечник также изменяет распределение масс в снаряде, улучшая его аэродинамическую устойчивость.
Подобные сплавы типа «Стабилла» применяются в стреловидных оперённых снарядах танковых и противотанковых артиллерийских орудий.
Процесс разрушения брони сопровождается измельчением в пыль урановой болванки и воспламенением её на воздухе с другой стороны брони (см. Пирофорность). Около 300 тонн обеднённого урана остались на поле боя во время операции «Буря в Пустыне» (по большей части это остатки снарядов 30-мм пушки GAU-8 штурмовых самолётов A-10, каждый снаряд содержит 272 г уранового сплава).
Такие снаряды были использованы войсками НАТО в боевых действиях на территории Югославии[21]. После их применения обсуждалась экологическая проблема радиационного загрязнения территории страны.
Впервые уран в качестве сердечника для снарядов был применен в Третьем рейхе.
Обеднённый уран используется в современной танковой броне, например, танка M-1 «Абрамс».
Физиологическое действие
В микроколичествах (10−5—10−8 %) обнаруживается в тканях растений, животных и человека. В наибольшей степени накапливается некоторыми грибами и водорослями. Соединения урана всасываются в желудочно-кишечном тракте (около 1 %), в легких — 50 %. Основные депо в организме: селезёнка, почки, скелет, печень, лёгкие и бронхо-лёгочные лимфатические узлы. Содержание в органах и тканях человека и животных не превышает 10−7г.
Уран и его соединения токсичны. Особенно опасны аэрозоли урана и его соединений. Для аэрозолей растворимых в воде соединений урана ПДК в воздухе 0,015 мг/м³, для нерастворимых форм урана ПДК 0,075 мг/м³. При попадании в организм уран действует на все органы, являясь общеклеточным ядом. Уран практически необратимо, как и многие другие тяжелые металлы, связывается с белками, прежде всего, с сульфидными группами аминокислот, нарушая их функцию. Молекулярный механизм действия урана связан с его способностью подавлять активность ферментов. В первую очередь поражаются почки (появляются белок и сахар в моче, олигурия). При хронической интоксикации возможны нарушения кроветворения и нервной системы.
Разведанные запасы урана в мире
Количество урана в земной коре примерно в 1000 раз превосходит количество золота, в 30 раз — серебра, при этом, данный показатель приблизительно равен аналогичному показателю у свинца и цинка. Немалая часть урана рассеяна в почвах, горных породах и морской воде. Только относительно небольшая часть концентрируется в месторождениях, где содержание данного элемента в сотни раз превышает его среднее содержание в земной коре[22]. Разведанные мировые запасы урана в месторождениях составляют 5,4 млн тонн[23].
Добыча урана в мире
 |
В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.Эта отметка установлена 23 августа 2011. |
|---|

10 стран, дающих 94 % мировой добычи урана
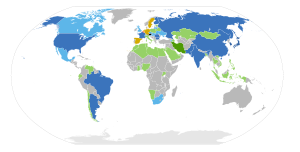
Согласно «Красной книге по урану»[23], выпущенной ОЭСР, в 2005 добыто 41 250 тонн урана (в 2003 — 35 492 тонны). Согласно данным ОЭСР, в мире функционирует 440 реакторов коммерческого назначения и около 60 научных, которые потребляют в год 67 тыс. тонн урана. Это означает, что его добыча из месторождений обеспечивала лишь 60 % объёма его потребления (на 2009 г. эта доля возросла до 79 %[24]). Остальной уран, потребляемый энергетикой или 17,7 %, поступает из вторичных источников.

Страны с АЭС: эксплуатируются АЭС, строятся новые энергоблоки. эксплуатируются АЭС, планируется строительство новых энергоблоков эксплуатируются АЭС, строительство новых пока не планируется эксплуатируются АЭС, рассматривается сокращение их количества Страны без АЭС: строительство планируется станций нет и не планируются гражданская ядерная энергетика запрещена законом
Добыча U по странам в тоннах по содержанию на 2005, 2009 и 2012 гг
| № | Страна | 2005 год | Страна | 2009 год | Страна | 2012 год |
|---|---|---|---|---|---|---|
| 1 |  Канада Канада |
11 410 |  Казахстан Казахстан |
14 020 | ||
| 2 |  Австралия Австралия |
9044 |  Канада Канада |
10 173 | ||
| 3 |  Казахстан Казахстан |
4020 |  Австралия Австралия |
7982 | ||
| 4 |  Россия Россия |
3570 |  Намибия Намибия |
4626 | ||
| 5 |  США США |
1249 |  Россия Россия |
3564 | ||
| 6 |  Украина Украина |
920 |  Нигер Нигер |
3234 | ||
| 7 |  КНР КНР |
920 |  Узбекистан Узбекистан |
2429 |
Добыча по компаниям на 2006, 2009 и 2011 г. в тоннах
| № | Страна | Компания | 2006 год | Страна | Компания | 2009 год | Страна | Компания | 2011 год |
|---|---|---|---|---|---|---|---|---|---|
| 1 |  |
Cameco | 8 100 |  |
Areva | 8 600 |  |
Areva | |
| 2 |   |
Rio Tinto | 7 000 |  |
Cameco | 8 000 |  |
KazAtomProm | |
| 3 |  |
Areva | 5 000 |   |
Rio Tinto | 7 900 |  |
Cameco | 9 930 |
| 4 |  |
KazAtomProm | 3 800 |  |
KazAtomProm | 7 500 |  |
ARMZ | 7 300 |
| 5 |  |
ARMZ | 3 500 |  |
ARMZ | 4 600 |   |
BHP Billiton | |
| 6 |   |
BHP Billiton | 3 000 |   |
BHP Billiton | 2 900 |   |
Rio Tinto | |
| 7 |  |
Navoi | 2 100 |  |
Navoi | 2 400 |  |
Navoi | 2 800 |
| 8 |  |
Uranium One | 1 000 |   |
Uranium One | 1 400 | |||
| 9 |  |
Heathgate | 800 |  |
Paladin Energy | 1 200 | |||
| 10 |  |
Denison Mines | 500 |  |
General Atomics | 600 |
Данные по ARMZ  даны с учетом приобретенной в 2010 г компанией Uranium One
даны с учетом приобретенной в 2010 г компанией Uranium One  , также в 2010г появилась информация о возможном слиянии BHP Billiton и Rio Tinto
, также в 2010г появилась информация о возможном слиянии BHP Billiton и Rio Tinto 

Уран для «научных и военных» целей
Большая часть урана для «научных и военных» целей извлекается из старых ядерных боеголовок:
- по договору СНВ-II 352 тонны — из оговорённых 500 (несмотря на то что договор не вступил в силу, в связи выходом России из договора 14 июня 2002)
- по договору СНВ-I (вступил в силу 5 декабря 1994 г, истек 5 декабря 2009 года) с российской стороны 500 тонн,
- по договору СНВ-III (ДСНВ) — договор подписан 8 апреля 2010 года в Праге. Договор сменил истёкший в декабре 2009 года СНВ-I.
Добыча в России
В СССР основными уранорудными регионами были Украина (месторождение Желтореченское, Первомайское и др.), Казахстан (Северный — Балкашинское рудное поле и др.; Южный — Кызылсайское рудное поле и др.; Восточный; все они принадлежат преимущественно вулканогенно -гидротермальному типу); Забайкалье (Антей, Стрельцовское и др.); Средняя Азия, в основном Узбекистан с оруденениями в чёрных сланцах с центром в г. Учкудук. Имеется масса мелких рудопроявлений и проявлений. В России основным урановорудным регионом осталось Забайкалье. На месторождении в Читинской области (около города Краснокаменск) добывается около 93 % российского урана. Добычу осуществляет шахтным способом «Приаргунское производственное горно-химическое объединение» (ППГХО), входящее в состав ОАО «Атомредметзолото» (Урановый холдинг).
Остальные 7 % получают методом подземного выщелачивания ЗАО «Далур» (Курганская область) и ОАО «Хиагда» (Бурятия).
Полученные руды и урановый концентрат перерабатываются на Чепецком механическом заводе.
По годовому производству урана (около 3,3 тыс. т.) Россия занимает 4 место после Казахстана. Годовое же потребление урана в России сейчас составляет 16 тыс. т и складывается из расходов на собственные АЭС в объёме 5,2 тыс. т, а также на экспорт тепловыделяющих средств (5,5 тыс. т) и низкообогащенного урана (6 тыс. т)[25].
Добыча в Казахстане
В Казахстане сосредоточена примерно пятая часть мировых запасов урана (21 % и 2 место в мире). Общие ресурсы урана порядка 1,5 млн тонн, из них около 1,1 млн тонн можно добывать методом подземного выщелачивания[26].
В 2009 году Казахстан вышел на первое место в мире по добыче урана (добыто 13 500 тонн)[27].
Добыча на Украине
Основное предприятие — Восточный горно-обогатительный комбинат в городе Жёлтые Воды.
Стоимость
Несмотря на бытующие легенды о десятках тысяч долларов за килограммовые или даже грамовые количества урана, реальная его цена на рынке не очень высока — необогащённая окись урана U3O8 стоит меньше 100 американских долларов за килограмм[28].
Разработка урановых руд рентабельна при цене на уран в районе 80 долл./кг. В настоящее время цена урана не позволяет налаживать эффективную разработку его месторождений, поэтому существуют прогнозы, что возможен рост цены на уран до 75-90 долл./кг к 2013—2014 гг.[29]
К 2030 г. будут полностью отработаны крупные и доступные месторождения с запасами до 80 дол./кг и в освоение начнут вовлекаться труднодоступные месторождения с себестоимостью производства более 130 дол./кг урана[30]
Связано это с тем, что для запуска атомного реактора на необогащённом уране нужны десятки или даже сотни тонн топлива, а для изготовления ядерного оружия следует обогатить большое количество урана для получения пригодных для создания бомбы концентраций[31].
См. также
 |
Уран (элемент) на Викискладе? |
|---|
Ссылки
- И. Н. Бекман. «Уран». Учебное пособие. Вена, 2008, Москва, 2009. (в формате PDF)
- Уран на Webelements
- Уран в Популярной библиотеке химических элементов
- Nuclear Weapons Frequently Asked Questions
- Россия продала США значительные запасы оружейного урана
- Уран на chemister.ru
Примечания
- ↑ Редкол.: Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 41.
- ↑ WebElements Periodic Table of the Elements | Uranium | crystal structures
- ↑ Уран в Толковом словаре русского языка под ред. Ушакова
- ↑ Энциклопедия «Кругосвет»
- ↑ Уран. Информационно-аналитический центр «Минерал»
- ↑ Сырьевая база урана. С. С. Наумов, ГОРНЫЙ ЖУРНАЛ, N12,1999
- ↑ G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties
- ↑ G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
- ↑ В урановых рудах в следовых количествах присутствует уран-236, образующийся из урана-235 при нейтронном захвате; в ториевых рудах имеются следы урана-233, возникающего из тория-232 после нейтронного захвата и двух последовательных бета-распадов. Однако содержание этих изотопов урана настолько мало, что может быть обнаружено лишь в специальных высокочувствительных измерениях.
- ↑ Rosholt J.N., et al. Isotopic fractionatio of uranium related to role feature in Sandstone, Shirley Basin, Wyoming.//Economic Geology, 1964, 59, 4, 570—585
- ↑ Rosholt J.N., et al. Evolution of the isotopic composition of uranium and thorium in Soil profiles.//Bull.Geol.Soc.Am./1966, 77, 9, 987—1004
- ↑ Чалов П. И. Изотопное фракционирование природного урана. — Фрунзе: Илим, 1975.
- ↑ Tilton G.R. et al. Isotopic composition and distribution of lead, uranium, and thorium in a precambrian granite.//Bull.Geol.Soc.Am., 1956, 66, 9, 1131—1148
- ↑ Шуколюков Ю. А. и др. Изотопные исследования „природного ядерного реактора“.//Геохимия, 1977, 7. С. 976—991.
- ↑ Мешик Алекс. Древний ядерный реактор.//В мире науки. Геофизика. 2006.2
- ↑ Реми Г. Неорганическая химия. т.2. М., Мир, 1966. С. 206—223
- ↑ Кац Дж, Рабинович Е. Химия урана. М., Изд-во иностранной литературы, 1954.
- ↑ Хмелевской В. К. Геофизические методы исследования земной коры. Международный университет природы, общества и человека „Дубна“, 1997.
- ↑ Справочник по геологии нефти и газа /Под ред. Еременко Н. А. — М.: Недра, 1984
- ↑ 1 2 3 4 5 Техническая энциклопедия 1927 года», том 24, столб. 596…597, статья «Уран»
- ↑ http://www.pdhealth.mil/downloads/Characterisation_of_DU_projectiles.pdf
- ↑ Добыча урана в мире
- ↑ 1 2 NEA, IAEA Uranium 2005 – Resources, Production and Demand. — OECD Publishing, 2006. — ISBN 9789264024250
- ↑ World Nuclear Association. Supply of Uranium. 2011.
- ↑ Минерально-сырьевая база и производство урана в Восточной Сибири и на Дальнем Востоке. Машковцев Г. А., Мигута А. К., Щеточкин В. Н., Минеральные ресурсы России. Экономика и управление, 1-2008
- ↑ Добыча урана в Казахстане. Доклад Мухтара Джакишева
- ↑ Конырова, К. Казахстан вышел на первое место по добыче урана в мире (рус.), Информационное агентство TREND (30.12.2009). Проверено 30 декабря 2009.
- ↑ Удо Ретберг; Перевод Александра Полоцкого Цены на уран растут (рус.). Перевод (12.08.2009). Архивировано из первоисточника 23 августа 2011. Проверено 12 мая 2010.
- ↑ Эксперты о прогнозе цен на уран Российское атомное сообщество
- ↑ http://2010.atomexpo.ru/mediafiles/u/files/Present/9.1_A.V.Boytsov.pdf
- ↑ Ядерное оружие См. подраздел про урановую бомбу.
Соединения урана
Аммония диуранат ((NH4)2U2O7) • Ацетат уранила (UO2(CH3COO)2) • Боргидрид урана (U(BH4)4) • Бромид урана(III) (UBr3) • Бромид урана(IV) (UBr4) • Бромид урана(V) (UBr5) • Гидрид урана(III) (UH3) • Гидроксид урана(III) (U(OH)3) • Гидроксид уранила (UO2(OH)2) • Диурановая кислота (H2U2O7) • Иодид урана(III) (UJ3) • Иодид урана(IV) (UJ4) • Карбонат уранила (UO2CO3) • Монооксид урана (UO) • US • UP • Натрия диуранат (Na2U2O7) • Натрия уранат (Na2UO4) • Нитрат уранила (UO2(NO3)2) • Нонаоксид тетраурана (U4O9) • Оксид урана(IV) (UO2) • Оксид урана(VI)-диурана(V) (U3O8) • Пероксид урана (UO4) • Сульфат урана(IV) (U(SO4)2) • Сульфат уранила (UO2SO4) • Тридекаоксид пентаурана (U5O13) • Триоксид урана (UO3) • Урановая кислота (H2UO4) • Формиат уранила (UO2(CHO2)2) • Фосфат урана(III) (U2(PO4)3) • Фторид урана(III) (UF3) • Фторид урана(IV) (UF4) • Фторид урана(V) (UF5) • Фторид урана(VI) (UF6) • Фторид уранила (UO2F2) • Хлорид урана(III) (UCl3) • Хлорид урана(IV) (UCl4) • Хлорид урана(V) (UCl5) • Хлорид урана(VI) (UCl6) • Хлорид уранила (UO2Cl2) •
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| Щелочные металлы Щёлочноземельные металлы Лантаноиды Актиноиды Переходные металлы Другие металлы Металлоиды Другие неметаллы Галогены Инертные газы |
 Электрохимический ряд активности металлов Электрохимический ряд активности металлов |
|---|
| Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au Элементы расположены в порядке возрастания стандартного электродного потенциала. |