Плутоний | это... Что такое Плутоний? (original) (raw)
236
2,85 лет
3,5·109 лет
α
СД
α 5,768 (69 %)
5,721 (31 %)
23592U(α,3n)
Доч.

Кольцо чистого, электрорафинированного оружейного плутония (99,9 %). Кольцо весит 5,3 кг, имеет размер 11 см в диаметре. Эта форма не позволяет ему иметь критический размер.
Из изотопов плутония на данный момент известно о существовании 19-ти его нуклидов с массовыми числами 228—247[135]. Только 4 из них нашли свое применение[16]. Свойства изотопов имеют некоторую характерную особенность, по которой можно судить об их дальнейшем изучении — четные изотопы имеют бо́льшие периоды полураспада, чем нечетные (однако данное предположение относится только к менее важным его нуклидам).
Министерство энергетики США делит смеси плутония на три вида[136]:
- оружейный плутоний (содержание 240Pu в 239Pu менее 7 %)
- топливный плутоний (от 7 до 18 % 240Pu) и
- реакторный плутоний (содержание 240Pu более 18 %)
Термин «сверхчистый плутоний» используется для описания смеси изотопов плутония, в которых содержатся 2—3 процента 240Pu[136].
Всего два изотопа этого элемента (239Pu и 241Pu) являются более способными к ядерному делению, нежели остальные; более того, это единственные изотопы, которые подвергаются ядерному делению при действии тепловых нейтронов[136]. Среди продуктов взрыва термоядерных бомб обнаружены также 247Рu и 255Рu [4], периоды полураспада которых несоизмеримо малы.
Изотопы и синтез

Методы экстракции плутония и урана.
Известны около 20 изотопов плутония, все они радиоактивны. Самым долгоживущим из них является плутоний-244, с периодом полураспада 80,8 млн лет; плутоний-242 имеет более короткий период полураспада — 372 300 лет; плутоний-239 — 24 110 лет'. Все остальные изотопы имеют период полураспада меньше 7 тыс. лет. Этот элемент имеет 8 метастабильных состояний, периоды полураспада этих изомеров не превышают 1 с[107].
Массовое число известных изотопов элемента варьируется от 228 до 247. Все они испытывают один или несколько типов радиоактивного распада:
- электронный захват (и, при достаточной энергии, позитронный бета-распад) с образованием изотопов нептуния;
- бета-минус-распад с образованием изотопов америция;
- альфа-распад с образованием изотопов урана;
- спонтанное деление с образованием широкого спектра дочерних изотопов элементов из средней части периодической таблицы, многие из которых β−-активны.
Основным каналом распада наиболее лёгких изотопов плутония (с 228 по 231) является альфа-распад, хотя канал электронного захвата для них также открыт. Основным каналом распада лёгких изотопов плутония (с 232 по 235 включительно) является электронный захват, с ним конкурирует альфа-распад. Основными каналами радиоактивного распада изотопов с массовыми числами между 236 и 244 (кроме 237[137], 241[137] и 243) являются альфа-распад и (с меньшей вероятностью) спонтанное деление. Основным каналом распада изотопов плутония, массовые числа которых превосходят 244 (а также 243Pu и 241Pu), является бета-минус-распад в изотопы америция (95 протонов). Плутоний-241 является членом «вымершего» радиоактивного ряда нептуния[51][107].
Бета-стабильными (то есть испытывающими лишь распады с изменением массового числа) являются изотопы с массовыми числами 236, 238, 239, 240, 242, 244.
Синтез плутония
Плутоний в промышленных масштабах получается двумя путями[136]:
- облучением урана (см. реакцию ниже), содержащегося в ядерных реакторах;
- облучением в реакторах трансурановых элементов, выделенных из отработанного топлива.
После облучения в обоих случаях выполняется отделение химическими способами плутония от урана, трансурановых элементов и продуктов деления.
Плутоний-238
Плутоний-238, использующийся в радиоизотопных генераторах энергии, лабораторно может синтезироваться в обменной (d, 2n)-реакции на уране-238:
![\mathrm{^{238}_{\ 92}U\ +\ ^{2}_{1}D\ \longrightarrow \ ^{238}_{\ 93}Np\ +\ 2\ ^{1}_{0}n~;\quad ^{238}_{\ 93}Np\ \xrightarrow[2.117 \ d]{\beta^-} \ ^{238}_{\ 94}Pu}](https://dic.academic.ru/dic.nsf/ruwiki/81f6733b2231b4b0cb86aff7b4d78001.png)
В данном процессе дейтрон попадает в ядро урана-238, в результате чего образуется нептуний-238 и два нейтрона. Далее нептуний-238 испытывает бета-минус-распад в плутоний-238. Именно в этой реакции был впервые получен плутоний (1941, Сиборг). Однако она неэкономична. В промышленности плутоний-238 получают двумя путями:
- выделением из облучённого ядерного топлива (в смеси с другими изотопами плутония, разделение которых очень дорого), поэтому чистый плутоний-238 таким методом не нарабатывается
- с помощью нейтронного облучения в реакторах нептуния-237.
Цена одного килограмма плутония-238 составляет примерно 1 млн долларов США[24].
Плутоний-239
Плутоний-239, делящийся изотоп, используемый в ядерном оружии и в ядерной энергетике, промышленно синтезируется[10] в ядерных реакторах (в том числе в энергетических как побочный продукт) с помощью следующей реакции при участии ядер урана и нейтронов с помощью бета-минус-распада и с участием изотопов нептуния как промежуточного продукта распада[138]:
![\mathrm{^{238}_{\ 92}U\ +\ ^{1}_{0}n\ \xrightarrow{\gamma} \ ^{239}_{\ 92}U\ \xrightarrow[23.5 \ min]{\beta^-} \ ^{239}_{\ 93}Np\ \xrightarrow[2.3565 \ d]{\beta^-} \ ^{239}_{\ 94}Pu}](https://dic.academic.ru/dic.nsf/ruwiki/83a2e4c88a76dddba8f22e402dacbb09.png)
Нейтроны, излучаемые при делении урана-235, захватываются ураном-238 с образованием урана-239; затем через цепочку двух β−-распадов образуются нептуний-239 и далее плутоний-239[139]. Сотрудники засекреченной британской группы Tube Alloys (англ.), которые занимались изучением плутония во время 2-ой мировой войны, предсказали существование данной реакции в 1940 г.
Тяжёлые изотопы плутония

Ядерные циклы, позволяющие получать более тяжёлые изотопы плутония.
Более тяжёлые изотопы нарабатываются в реакторах из 239Pu по цепочке последовательных нейтронных захватов, каждый из которых увеличивает массовое число нуклида на единицу.
Свойства некоторых изотопов
Изотопы плутония претерпевают радиоактивный распад, вследствие которого выделяется тепловая энергия. Разные изотопы излучают разное количество тепла. Тепловыделение обычно записывается в пересчёте на Вт/кг или мВт/кг. В случаях, когда плутоний присутствует в больших количествах и нет теплоотвода, тепловая энергия может расплавить содержащий плутоний материал.
Все изотопы плутония способны к ядерному делению (при воздействии нейтрона)[140] и излучают γ-частицы.
| Выделение тепла изотопами плутония[141] | |||||
|---|---|---|---|---|---|
| Изотоп | Тип распада | Период полураспада(в годах) | Тепловыделение (Вт/кг) | Спонтанное делениенейтроны (1/(гр·с)) | Комментарий |
| 238Pu | альфа в 234U | 87,74 | 560 | 2600 | Очень высокая температура распада. Даже в небольших количествах может привести к саморазогреву. Используется в РТГ. |
| 239Pu | альфа в 235U | 24100 | 1,9 | 0,022 | Основной ядерный продукт. |
| 240Pu | альфа в 236U, спонтанное деление | 6560 | 6,8 | 910 | Является основной примесью в плутонии-239. Высокий показатель спонтанного деления не позволяет использовать в ядерной промышленности. |
| 241Pu | бета в 241Am | 14,4 | 4,2 | 0,049 | Распадается до америция-241; его накопление представляет угрозу для полученных образцов. |
| Уран-233 | 15 | 11 | [142] | ||
| Уран-235 | 52 | 17 | [142] | ||
| Нептуний-236 | 7 | 8,7 | [143] | ||
| Нептуний-237 | 60 | 18 | [144] | ||
| Плутоний-238 | 9,04—10,07 | 9,5—9,9 | [145] | ||
| Плутоний-239 | 10 | 9,9 | [142][145] | ||
| Плутоний-240 | 40 | 15 | [142] | ||
| Плутоний-241 | 12 | 10,5 | [146] | ||
| Плутоний-242 | 75—100 | 19—21 | [146] |
Плутоний-236 был найден в плутониевой фракции, полученной из природного урана, при измерении радиоизлучения которой наблюдался пробег α-частиц, равный 4,35 см (что соответствует 5,75 МэВ). Было установлено, что данная группа относилась к изотопу 236Pu, образующемся благодаря реакции 235U(α,3n)236Pu. Позднее было обнаружено, что возможны такие реакции как: 237Np(a, p4n)236Pu; 237Np(α,5n)236Am → (ЭЗ) 236Pu. В настоящее время его получают благодаря взаимодействию дейтрона с ядром урана-235. Изотоп образуется благодаря α-излучателю альфа-излучателем, способным с спонтанному делению. Скорость самопроизвольного деления составляет 5,8·107 делений на 1 г/ч, что соответствует периоду полураспада для этого процесса — 3,5·109 лет[35].
Плутоний-238 имеет интенсивность самопроизвольного деления 1,1·106 делений/с·кг, что в 2,6 раза больше 240Pu, и очень высокую тепловую мощность: 567 Вт/кг. Изотоп обладает очень сильным альфа-излучением (при воздействии на него нейтронов[51]), которое в 283 раза сильнее 239Pu, что делает его более серьёзным источником нейтронов при реакции α → n. Содержание плутония-238 редко когда превышает 1 % от общего состава плутония, однако излучение нейтронов и нагрев делают его очень неудобным для обращения[147]. Его удельная радиоактивность составляет 17,1 кюри/г[148].
Плутоний-239 имеет большие сечения рассеивания и поглощения, чем уран и большее число нейтронов в расчете на одно деление, и меньшую критическую массу[147], которая составляет 10 кг в альфа-фазе[141]. При ядерном распаде плутония-239 посредством воздействия на него нейтронами, этот нуклид распадается на два осколка (примерно равные между собой более лёгкие атомы), выделяя примерно 200 МэВ энергии. Это приблизительно в 50 млн раз больше выделяемой при горении энергии (C+O2 → CO2↑). «Сгорая» в ядерном реакторе изотоп выделяет 2·107 ккал[16]. Чистый 239Pu имеет среднюю величину испускания нейтронов от спонтанного деления примерно 30 нейтронов/с·кг (примерно 10 делений в секунду на килограмм). Тепловая мощность составляет 1,92 Вт/кг (для сравнения: теплота обмена веществ у взрослого человека составляет меньшую тепловую мощность), что делает его теплым на ощупь. Удельная активность равна 61,5 мКи/г[147].
Плутоний-240 является основным изотопом загрязняющим оружейный 239Pu. Уровень его содержания главным образом важен из-за интенсивности спонтанного деления, которая составляет 415 000 делений/с·кг, но испускается примерно 1·105 нейтронов/с·кг, так как каждое деление рождает приблизительно 2,2 нейтрона, что примерно в 30 000 раз больше, чем у 239Pu. Плутоний-240 хорошо делится, чуть лучше чем 235U. Тепловой выход больше, чем у плутония-239 и составляет 7,1 Вт/кг, что обостряет проблему перегрева. Удельная активность равна 227 мКи/г[147].
Плутоний-241 имеет низкий нейтронный фон и умеренную тепловую мощность и потому непосредственно не влияет на удобство применения плутония (Тепловая мощность равна 3,4 Вт/кг). Однако он с периодом полураспада 14 лет превращается в америций-241, который плохо делится и обладает большой тепловой мощностью, ухудшая качество оружейного плутония. Таким образом, плутоний-241 влияет на старение оружейного плутония. Удельная активность — 106 Ки/г[147].
Интенсивность испускания нейтронов плутония-242 составляет 840 000 делений/с·кг (вдвое выше 240Pu), плохо подвержен ядерному делению. При заметной концентрации серьёзно увеличивает требуемую критическую массу и нейтронный фон. Имея большую продолжительность жизни и маленькое сечение захвата нуклид накапливается в переработанном реакторном топливе. Удельная активность составляет 4 мКи/г[147].
Сплавы
Сплавы плутония, или интерметаллические соединения, обычно получают прямым взаимодействием элементов в нужных отношениях[13]. В большинстве случаев для получения гомогенного вещества применяют дуговую плавку; иногда нестабильные сплавы можно получить распылительным осаждением[149][150] или охлаждением расплавов[151].
| δ-Стабилизаторы[13] | |||
|---|---|---|---|
| Группа | Растворенныйметалл | Разница в размерах, % | Минимальное количество растворенного металла,необходимое для стабилизации δ-фазы, % |
| III A | Sc Lu Tm Er Dy Ce | −0,2+5,5+6,2+6,9+7,8+4,3 | 2,75±0,254,1±0,3<54,1±0,34,1±0,35[~ 14] |
| III B | Ga Al In Tl | −14,2−12,9+1,2+4,4 | 2[~ 15]1[~ 16]1±0,23,6±0,54,4±0,6 |
| IV A | Hf Zr | −3,9−2,6 | 4,6±0,57,0±0,5 |
Легированные алюминием, галлием или железом, сплавы плутония имеют промышленное значение[1].
Плутоний может образовывать сплавы и промежуточные соединения с большинством металлов. Исключениями являются литий, натрий, калий и рубидий из щелочных металлов; магний, кальций, стронций и барий из щелочноземельных металлов; европий и иттербий из РЗЭ[58]. Частичными исключениями являются тугоплавкие металлы: хром, молибден, ниобий, тантал и вольфрам, которые растворимы в жидком плутонии, но почти нерастворимые или малорастворимые в твёрдом плутонии[58]. Галлий, алюминий, америций, скандий и церий могут стабилизировать δ-плутоний при комнатной температуре. Кремний, индий, цинк и цирконий способны к формированию метастабильного δ-плутония (δ'-фаза) при быстром охлаждении. Большие количества гафния, гольмия и таллия иногда позволяют сохранить некоторое количество δ-плутония при комнатной температуре. Нептуний является единственным элементом, который может стабилизировать α-плутоний при высоких температурах. Титан, гафний и цирконий стабилизируют структуру β-плутония при комнатной температуре при резком охлаждении[109].
Сплавы плутония могут быть получены при добавлении металла в расплавленный плутоний. Если легирующий металл является достаточно сильным восстановителем, то в этом случае плутоний используется в виде оксидов или галогенидов. Сплавы δ-плутоний-галлий и плутоний-алюминий получают путём добавления фторида плутония(III) в расплавленный галлий или алюминий, который имеет особенность, заключающуюся в том, что алюминий не реагирует с высокоактивным плутонием[152].
Виды сплавов
 Внешние изображения Внешние изображения |
|
|---|---|
 |
Сплав плутоний-галлий |
- Плутоний-галлий — сплав, использующийся для стабилизации δ-фазы плутония, который позволяет избежать переход α—δ фаза[106].
- Плутоний-алюминий — альтернативный сплав, по своим свойствам аналогичен сплаву Pu-Ga. Данный сплав может быть использован в качестве компонента ядерного топлива[153].
- Плутоний-галлий-кобальт (PuGaCo5) — сверхпроводниковый сплав при температуре, составляющей 18,5 К. Необычно высокая температура перехода может свидетельствовать о том, что вещества на основе плутония представляют собой новый класс сверхпроводников[118][154][14].
- Плутоний-цирконий — сплав, который иногда может быть использован в качестве ядерного топлива[155].
- Плутоний-церий и плутоний-церий-кобальт — сплавы, используемые в качестве ядерного топлива[156].
- Плутоний-уран — сплав, содержания плутония в котором примерно равно 15—30 молей в процентном содержании. Используется в ядерных реакторах, работающих на быстрых нейтронах. Сплав имеет пирофорный характер, высокую восприимчивость к коррозии при достижении точки самовоспламенения, или способен к разложению при воздействии на него кислородом. Данный сплав требует легирования с другими металлами. Добавление алюминия, углерода или меди не сможет существенно улучшить свойства сплава; добавление циркония или сплавов железа повысят коррозионную стойкость данного сплава, однако после нескольких месяцев воздействия воздуха на легированный сплав данные качества теряются. Добавление титана и/или циркония позволит существенно повысить температуру плавления сплава[157].
- Плутоний-уран-титан и плутоний-уран-цирконий — сплав, исследование которого предполагало его использование в качестве ядерного топлива. Добавление третьего элемента (титан и/или цирконий) в эти сплавы позволит улучшить устойчивость к коррозии, снизить возможность воспламенения, повысить пластичность, технологичность, прочность и тепловое расширение. Сплав плутоний-уран-молибден имеет наилучшую устойчивость к коррозии, так как образовывает на своей поверхности оксидную плёнку[157].
- Сплав торий-уран-плутоний был исследован в качестве топлива для ядерных реакторах, работающих на быстрых нейтронах[157].
Меры предосторожности
Токсичность
Все химические элементы в той или иной степени токсичны, если их концентрация в организме превышает установленные нормы. Например, некоторые лантаноиды цериевой группы могут находится в молоке, крови и костях животных, а остальные в люпине, сахарной свекле, чернике, разных водорослях и др[22]. Нахождение этих элементов в живых организмах объясняется в первую очередь стабильностью их изотопов, в то время как у актиноидов ситуация совсем другая. Все изотопы этой группы в той или иной степени, в том числе плутония, радиоактивны. Из этого следует, что нахождение элементов этой группы в живых организмах исключено. Данное свойство объясняется их радиоактивностью: α, β и γ-излучение пагубно воздействует на все живое, разрушая клетки организма.
Все соединения одного элемента данной группы — плутония — являются ядовитыми. Данные свойства проявляются как следствие α-излучения, так как зачастую приходится работать с α-активными изотопами (например, 239Pu). Альфа-частицы представляют серьёзную опасность в том случае, если их источник находится в теле зараженного. При этом они повреждают окружающие элемент ткани организма. Хотя плутоний способен излучать γ-лучи и нейтроны, которые могут проникать в тело снаружи, их уровень слишком мал для того, чтобы причинить вред здоровью. Разные изотопы плутония обладают разной токсичностью, например типичный реакторный плутоний в 8—10 раз токсичнее чистого 239Pu, так как в нём преобладают нуклиды 240Pu, который является мощным источником альфа-излучения[35].
Плутоний самый радиотоксичный элемент из всех актиноидов[158], однако считается отнюдь не самым опасным элементом. Если принять радиологическую токсичность 238U за единицу, этот же показатель для плутония и некоторых других элементов образует ряд:
235U (1,6) — 239Pu (5,0·104) — 241Am (3,2·106) — 90Sr (4,8·106) — 226Ra (3,0·107),
из которого следует вывод, что радий почти в тысячу раз опаснее самого ядовитого изотопа плутония — 239Pu[35][58].
При поступлении элемента вместе с водой и пищей плутоний менее ядовит, чем такие вещества как кофеин, ацетаминофен, некоторые витамины, псевдоэфедрин и множество растений и грибов. Он чуть менее вреден этилового спирта, но вреднее табака и всех запрещенных наркотиков. С химической точки зрения он ядовит так же как свинец. С точки зрения ингаляции плутоний — это рядовой токсин (примерно соответствует парам ртути). За всю историю ядерной индустрии достоверно известно об одном случае гибели человека от плутония, а смерти из-за плутония, попавшего в организм человека через лёгкие или желудок, до сих пор ни разу не случилось (при этом в счет не берутся данные о гибели 26 граждан США, которые погибли от передозировки, а также 18 добровольцев, которые подвергались изучению темпов выведения плутония из организма)[35][159].
При ингаляции плутоний обладает канцерогенными свойствами и способен вызвать рак лёгких. Однако следует помнить, что при попадании с пищей 14C и 40K гораздо более канцерогенны[источник не указан 496 дней]. Тем не менее, плутоний токсичен, так как имеет свойство концентрироваться в кроветворных участках костей и может вызвать заболевания через много лет после его попадания[35].
Альфа-частицы обладают относительно малой проникающей способностью: для 239Pu пробег α-частиц в воздухе составляет 3,7 см, а в мягкой биологической ткани 43 мкм. В совокупности с высокой полной ионизацией (1,47·107 пар ионов на одну α-частицу) небольшая величина пробега обуславливает значительную величину плотности ионизации; а чем выше её плотность, тем выше воздействие на организм. В связи с тем, что α-излучение приводит к необратимым изменениям в скелете, печени, селезёнке и почках, все изотопы элемента относят к группе элементов с особо высокой радиотоксичностью (группа A токсичности). Эти изменения трудно диагностировать; они не проявляются настолько быстро, что можно констатировать о нахождении элемента в организме[35]. Несмотря на малую проникающую способность, плутоний-239, в условиях эксперимента оказался способен вызывать хромосомные мутации и микроядра в клетках растений при контакте с живой тканью.[160]. Плутоний-238 в эксперименте по воздействию на клетки китайского хомяка, оказался способен повышать частоту хромосомных аберраций и сестринских хроматидных обменов при дозе в 0,5 рад (0,005 грей)[161]
Плутоний склонен к образованию аэрозолей[21]. Хотя плутоний и является металлом, он очень летуч. Например, стоит пронести его образец по комнате, как допустимое содержание элемента будет превышено. Поэтому в процессе дыхания он склонен проникать в легкие и бронхи. Значимы два типа воздействия: острое и хроническое отравление. Если уровень облучения достаточно высок, ткани могут страдать острым отравлением и токсическое воздействие проявляется очень быстро. Если уровень облучения мал, то образуется накопляющийся канцерогенный эффект[35].
Попавшее количество элемента определяется коэффициентом всасывания, составляющим K = 1·10−3. Для биологически связанного элемента коэффициент выше: K = 1·10−2, причем коэффициент всасывания возрастает в 10—100 раз для детей по сравнению к взрослым. Плутоний может попадать в организм через раны и ссадины, путём вдыхания или заглатывания. Однако наиболее опасным путем попадания в организм является поглощение из легких[35].
Попавший в лёгкие плутоний частично оседает на поверхности лёгких, частично переходит в кровь, а затем в лимфоузлы и костный мозг. Примерно 60 % попадает в костную ткань, 30 % в печень и 10 % выводится естественным путем. Количество попавшего в организм плутония зависит от величины аэрозольных частиц и растворимости в крови[35].
Плутоний очень плохо всасывается через желудочно-кишечный тракт. Плутоний в четырёхвалентном состоянии в течение нескольких суток на 70—80 % отлагается в печени человека и на 10—15 % в костных тканях. Попавший в организм элемент менее ядовит, чем такие известные яды как цианид или стрихнин. Поглощение всего 0,5 г плутония привело бы к смерти за несколько дней или недель за счет острого облучения пищеварительной системы (для цианида это значение составляет 0,1 г). Вдыхание 0,1 г плутония в виде частиц оптимального размера для удержания в лёгких приведет к смерти из-за отёка лёгких за 1—10 дней. Вдыхание 0,2 г приведет к смерти от фиброза за один месяц. Для намного меньших величин, попавших в организм, возникает высокий риск появления хронического канцерогенного эффекта[35].
Самой вероятной формой попадания плутония в организм является его практически не растворимый в воде оксид. Он применяется на АЭС в качестве источника электроэнергии[35]. Следовательно, плутоний, из-за нерастворимости его оксида, имеет большие показатели полувыведения из организма[158].
В природе плутоний чаще всего находится в четырёхвалентном состоянии, которое по своим химическим свойствам напоминает трехвалентное железо. Если он проникает в систему кровообращения, то с большой вероятностью начнет концентрироваться в тканях, содержащих железо: костный мозг, печень, селезёнка. Организм путает плутоний с железом, следовательно белок трансферина забирает плутоний вместо железа, в результате чего останавливается перенос кислорода в организме. Микрофаги растаскивают плутоний по лимфоузлам. Если 0,14 г разместятся в костях взрослого человека, то риск ухудшения иммунитета будет очень велик и через несколько лет может развиться рак[35]. Проведенные исследования элемента на токсичность показали, что для человека весом 70 кг смертельная доза составляет 0,22 г[158]
Попавший в организм плутоний выводится из него очень долго — на протяжении 50 лет из организма выведется всего 80 %. Период биологического полувыведения из костной ткани составляет 80—100 лет[35]. Получается, что его концентрация в костях практически постоянна[59]. Период полувыведения из печени составляет 40 лет. Максимально безопасным значением количества плутония в организме для 239Pu составляет 0,047 мкКи что эквивалентно 0,0075 г. Молоко выводит плутоний в 2—10 раз активнее воды[35].
Критическая масса
Критическая масса — минимальная масса делящегося вещества, при которой в нём может происходить самоподдерживающаяся ядерная реакция деления. Если масса вещества ниже критической, то слишком много нейтронов, необходимых для реакции деления, теряется, и цепная реакция не идёт. При массе больше критической цепная реакция может лавинообразно ускоряться, что приводит к ядерному взрыву.
Критическая масса зависит от размеров и формы делящегося образца, так как они определяют утечку нейтронов из образца через его поверхность. Минимальную критическую массу имеет образец сферической формы, так как площадь его поверхности наименьшая. Критическая масса чистого металлического плутония-239 сферической формы 11 кг (диаметр такой сферы 10 см), урана-235 — 50 кг (диаметр сферы 17 см). Критическая масса также зависит от химического состава образца. Отражатели и замедлители нейтронов, окружающие делящееся вещество, могут существенно снизить критическую массу.
Самовоспламенение
В мелкодисперсном состоянии плутоний, как и все актиниды, пребывает в состоянии пирофорности[69]. Во влажной среде плутоний на его поверхности образует гидриды переменного состава; реагируя с кислородом плутоний воспламеняется даже при комнатной температуре. В результате окисления плутоний расширяется на 70 % и может повредить содержащий его контейнер[162]. Радиоактивность плутония является препятствием для тушения. Песок из оксида магния наиболее эффективный материал для тушения: он охлаждает плутоний, а также блокирует доступ кислорода. Плутоний следует хранить либо в атмосфере инертного газа[162], либо при наличии циркулирующего воздуха (учитывая, что 100 г плутония-239 выделяют 0,2 Вт тепла)[69]. Элемент имеет исключительно высокую пирофорность при нагреве до 470—520 °C[1].
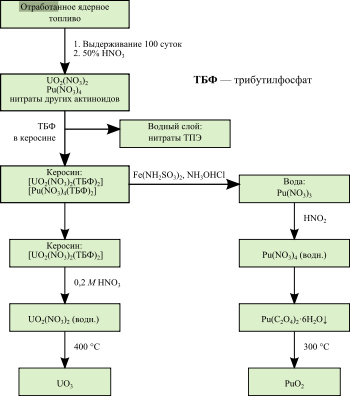
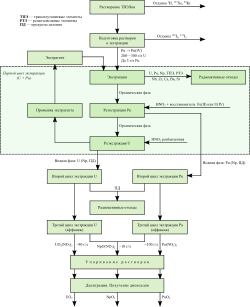
Методы отделения

Пьюрекс-процесс применяется для извлечения оксидов плутония, урана и нептуния высокой чистоты.
Обобщенное представление о способах отделения плутония от примесей, предшествующих элементов и их продуктов деления состоит из трех стадий. В первой стадии отработавшие тепловыделяющие сборки демонтируются, и оболочка, содержащая отработавший плутоний и уран, удаляется физическими и химическими способами. На втором этапе извлеченное ядерное топливо растворяют в азотной кислоте. На третьем и самом комплексном этапе отделения плутония от других актинидов и продуктов деления применяют технологию, известную как «solvent process» (рус. экстракция растворителем). Трибутилфосфат обычно используется в качестве экстрагента в керосиноподобном растворителе в пьюрекс-процессе. Как правило, очищение плутония и урана происходит в несколько этапов для достижения необходимой чистоты элементов[136]. Первоначально вышеупомянутый процесс был создан для переработки ядерного топлива реакторов, созданных для военных целей. Позднее эту технологию удалось применять и на энергетических реакторах[13].
Применение
Металлический плутоний используется в ядерном оружии и служит в качестве ядерного топлива. Оксиды плутония используются в качестве энергетического источника для космической техники и находят свое применение в ТВЭЛах[106]. Плутоний используется в элементах питания космических аппаратов[163]. Ядра плутония-239 способны к цепной ядерной реакции при воздействии на них нейтронов, поэтому этот изотоп можно использовать как источник атомной энергии (энергия, освобождающаяся при расщеплении 1 г 239Pu, эквивалентна теплоте, выделяющейся при сгорании 4000 кг угля)[59]. Более частое использование плутония-239 в ядерных бомбах обусловлено тем, что плутоний занимает меньший объём в сфере (где расположено ядро бомбы), следовательно можно выиграть во взрывной силе бомбы за счет этого свойства. Ядро плутония при ядерной реакции испускает всреднем около 2,895 нейтрона против 2,452 нейтрона у урана-235. Однако затраты на производство плутония примерно в шесть раз больше по сравнению с ураном-235[112].
Изотопы плутония нашли свое применение при синтезе трансплутониевых (последующих после плутония) элементов[4]. Таким образом, смешанный оксид плутония-242 в 2009 г. и бомбардировки ионами кальция-48 в 2010 году того же изотопа были использованы для получения флеровия[164][165][166][167]. В Оук-Риджской национальной лаборатории длительное нейтронное облучение 239Pu используется для получения трансурановые элементы производились в прошлом в исследовательских целях[69]. Благодаря нейтронному захвату изотопов плутония в 1944 году Г. Т. Сиборгом и его группой был одержан первый изотоп америция — 24195Am [117] (реакция 239Pu(2n, e)241Am)[37]. Для подтверждения того, что актиноидов всего 14 (по аналогии с лантаноидами) был произведен в 1966 году в Дубне синтез ядер резерфордия (в то время курчатовия) под руководством академика Г. Н. Флёрова[168][169]:
24294Pu + 2210Ne → сплавы плутония применяются при изготовлении топливных элементов, так как они обладают лучшими металлургическими свойствами по сравнению с чистым плутонием, который при нагревании претерпевает фазовые переходы[13].
«Сверхчистый» плутоний (смесь изотопов плутония, содержание в которой не превышает 2—3 % 240Pu) используется в ядерном оружии ВМФ США и применяется на кораблях и подводных лодках под ядерной защитой из свинца, что снижает дозовую нагрузку на команду[170].
Плутоний-238 и плутоний-239 являются самыми широко синтезируемыми изотопами[51].
- Первый ядерный заряд на основе плутония был взорван 16 июля 1945 года на полигоне Аламогордо (испытание под кодовым названием «Тринити»).
Ядерное оружие
Плутоний очень часто применялся в ядерных бомбах. Историческим фактом является сброс ядерной бомбы на Нагасаки в 1945 г. США. Бомба, сброшенная на этот город, содержала в себе 6,2 кг плутония[171]. Мощность взрыва составила 21 килотонну (взрыв оказался на 40 % больше, по сравнению с бомбардировкой Хиросимы)[172]. К концу 1945 года погибло 60—80 тыс. человек[173]. По истечении 5 лет, общее количество погибших, с учётом умерших от рака и других долгосрочных воздействий взрыва, могло достичь или даже превысить 140 000 человек[172].
[![Принцип имплозии, по которому действует ядерная бомба[~ 17].](https://dic.academic.ru/pictures/wiki/files/50/230px-Implosion_bomb_animated.gif) ](/pictures/wiki/files/73/Implosion%5Fbomb%5Fanimated.gif)
](/pictures/wiki/files/73/Implosion%5Fbomb%5Fanimated.gif)
[![Ядерный заряд в виде сферы[~ 18].](https://dic.academic.ru/pictures/wiki/files/50/230px-Partially-reflected-plutonium-sphere.jpeg) ](/pictures/wiki/files/80/Partially-reflected-plutonium-sphere.jpeg)
](/pictures/wiki/files/80/Partially-reflected-plutonium-sphere.jpeg)
Ядерный заряд в виде сферы[~ 18].
Принцип, по которому происходил ядерный взрыв с участием плутония, заключался в конструкции ядерной бомбы. «Ядро» бомбы состояло из сферы, наполненной плутонием-239, которая в момент столкновения с землей сжималась до миллиона атмосфер за счет конструкции[112] и благодаря окружающему эту сферу взрывчатому веществу[174]. После удара ядро расширялось в объёме и в плотности за десяток микросекунд, при этом сжимаемая сборка проскакивала критическое состояние на тепловых нейтронах и становилась существенно сверхкритической на быстрых нейтронах, то есть начиналась цепная ядерная реакция с участием нейтронов и ядер элемента[175]. При этом следовало учитывать, что бомба не должна была взорваться преждевременно. Однако это практически невозможно, так как, чтобы сжать плутониевый шар за десяток наносекунд всего на 1 см, требуется придать веществу ускорение, в десятки триллионов раз превышающее ускорение свободного падения. При конечном взрыве ядерной бомбы температура повышается до десятков миллионов градусов[112]. Следует отметить, что в наше время для создания полноценного ядерного заряда достаточно 8—9 кг этого элемента[176].
Всего один килограмм плутония-239 может произвести взрыв, который будет эквивалентен 20000 т тротила[51]. Даже 50 г элемента при делении всех ядер произведут взрыв, равный детонации 1000 т тротила[177]. Данный изотоп является единственным подходящим нуклидом для применения в ядерном оружии, так как присутствие хотя бы 1 % 240Pu приведет к образованию большого количества нейтронов, которые не позволят эффективно применять пушечную схему заряда ядерной бомбы. Остальные изотопы рассматриваются только из-за их вредного действия[147].
Плутоний-240 может находиться в ядерной бомбе в малых количествах, однако если его содержание будет повышено, произойдет преждевременная цепная реакция. Данный изотоп имеет высокую вероятность спонтанного деления (примерно 440 делений в секунду на грамм; высвобождается примерно 1000 нейтронов в секунду на грамм[178]), что делает невозможным большой процент его содержания в делящемся материале[76].
По данным телеканала Al-Jazeera, Израиль имеет около 118 боеголовок с плутонием в качестве радиоактивного вещества[179]. Считается, что Южная Корея имеет около 40 кг плутония, количества которого достаточно для производства 6 ядерных ракет[180]. По оценкам МАГАТЭ в 2007 году, производимого в Ираке плутония хватало на две ядерные боеголовки в год[181]. В 2006 г. Пакистан начал строительство ядерного реактора, который позволит нарабатывать около 200 кг радиоактивного элемента в год. В пересчете на количество ядерных боеголовок, эта цифра будет составлять приблизительно 40—50 бомб[182].
Между Россией и США было подписано несколько договоров на протяжении первого десятилетия 21-го века (на данный момент). Так в частности, в 2003 г. был подписан договор о переработке 68 т (по 34 т с каждой стороны) плутония на Балаковской АЭС в MOX-топливо до 2024 года[25]. В 2007 г. страны подписали план об утилизации Россией 34 т плутония, созданного для российских оружейных программ[176][183]. В 2010 году был подписан договор об утилизации ядерного оружия, в частности плутония, количества которого хватило бы на производство 17 тыс. ядерных боеголовок[184].
В 2010 году 17 ноября между США и Казахстаном было подписано соглашение о закрытии промышленного ядерного реактора БН-350 в городе Актау, который вырабатывал электроэнергию за счет плутония[185]. Этот реактор был первым в мире и Казахстане опытно-промышленным реактором на быстрых нейтронах; срок его работы составил 27 лет[186].
Ядерное загрязнение
В период, когда начинались ядерные испытания (1945—1963 гг.) в основе которых лежал плутоний, и когда его радиоактивные свойства только начинались изучаться, в атмосферу было выброшено свыше 5 т элемента[158]. С 1970-х годов доля плутония в радиоактивном заражении атмосферы Земли начала возрастать[1].
В северо-западную часть Тихого океана плутоний попал в основном благодаря ядерным испытаниям. Повышенное содержание элемента объясняется проведением США ядерных испытаний на территории Маршалловых Островов в Тихоокеанском полигоне в 1950-х годах. Основное загрязнение от этих испытаний пришлось на 1960 года. Исходя из оценки ученых, нахождение плутония в тихом океане повышено по сравнению с общим распространением ядерных материалов на земле[187]. По некоторым расчетам, доза облучения, исходящего от цезия-137, на атоллах Маршалловых островов составляет примерно 95 %, а на остальные 5 приходятся изотопы стронция, америция и плутония[188].
Плутоний в океане переносится благодаря физическим и биогеохимическим процессам. Время нахождения плутония в поверхностных водах океана составляет от 6 до 21 года, что, как правило, короче, чем у цезия-137. В отличие от этого изотопа, плутоний является элементом, частично реагирующим с окружающей средой и образующим 1—10 % нерастворимых соединений от общей массы, попавшей в окружающую среду (у цезия это значение составляет менее 0,1 %). Плутоний в океане выпадает на дно вместе с биогенными частицами, из которых он восстанавливается в растворимые формы в результате микробного разложения. Наиболее распространенными из его изотопов в морской среде являются плутоний-239 и плутоний-240[187].
В январе 1968 года, американский самолет B-52 с четырьмя зарядами ядерного оружия в результате неуспешной посадки разбился на льду вблизи Туле, на территории Гренландии. Столкновение вызвало взрыв и фрагментацию оружия, в результате чего плутоний попал на льдину. После взрыва верхний слой загрязненного снега была снесен и в результате образовалась трещина, через которую плутоний попал в воду[189]. Для уменьшения урона природе было собрано примерно 1,9 млрд литров снега и льда, которые могли подвергнуться радиоактивному загрязнению. Впоследствии оказалось, что один из четырёх зарядов так и не был найден[190].
Известен случай, когда советский космический аппарат Космос-954 24 января 1978 года с ядерным источником энергии на борту при неконтролируемом сходе с орбиты упал на территорию Канады. Данное происшествие привело к попаданию в окружающую среду 1 кг плутония-238 на площадь около 124 000 м²[191][192].
Попадание плутония в окружающую среду связано не только с техногенными происшествиями. Известны случаи утечки плутония как из лабораторных, так и из заводских условий. Было около 22 аварийных случаев утечки из лабораторий урана-235 и плутония-239. На протяжении 1953—1978 гг. аварийные случаи привели к потере от 0,81 (Маяк, 15 марта 1953 г.) до 10,1 кг (Томск, 13 декабря 1978 г.) 239Pu. Происшествия на промышленных предприятиях суммарно привели к смерти двух человек в г. Лос-Аламос (21.08.1945 и 21.05.1946) из-за двух случаев аварий и потерь 6,2 кг плутония. В городе Саров в 1953 и 1963 гг. примерно 8 и 17,35 кг попало за пределы ядерного реактора. Один из них привел к разрушению ядерного реактора в 1953 году[193].

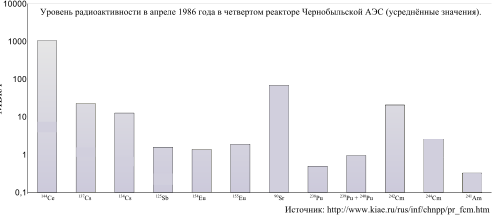
Уровни радиоактивности изотопов по состоянию на апрель 1986 года.
Известен случай аварии на Чернобыльской АЭС, который произошел 26 апреля 1986 года. В результате разрушения четвертного энергоблока в окружающую среду было выброшено 190 т радиоактивных веществ на площадь около 2200 км². Восемь из 140 т радиоактивного топлива реактора оказались в воздухе. Загрязненная площадь составила 160 000 км²[194]. Для ликвидации последствий были мобилизованы значительные ресурсы, более 600 тыс. человек участвовали в ликвидации последствий аварии. Суммарная активность веществ, выброшенных в окружающую среду, составила, по различным оценкам, до 14·1018 Бк (или 14 ЭБк), в том числе[195]:
- 1,8 ЭБк — 13153I,
- 0,085 ЭБк — 13755Cs,
- 0,01 ЭБк — 9038Sr
- 0,003 ЭБк — изотопы плутония,
- на долю благородных газов приходилось около половины от суммарной активности.
В настоящее время большинство жителей загрязнённой зоны получает менее 1 мЗв в год сверх естественного фона[195].
Источник энергии и тепла
 Внешние изображения Внешние изображения |
|
|---|---|
 |
Диоксид плутония |
Как известно, атомная энергия применяется для преобразования в электроэнергию за счет нагревания воды, которая испаряясь и образуя перегретый пар вращает лопатки турбин электрогенераторов. Преимуществом данной технологии является отсутствие каких либо парниковых газов, которые оказывают пагубное воздействие на окружающую среду. По состоянию за 2009 год 438 атомных станций по всему миру генерировали примерно 371,9 ГВт электроэнергии (или 13,8 % от общего объёма производства электроэнергии)[196]. Однако минусом ядерной промышленности являются ядерные отходы, которых в год отрабатывается приблизительно 12000 т[~ 19]. Данное количество отработанного материала представляет собой довольно сложную задачу перед сотрудниками АЭС[197]. К 1982 году было подсчитано, что аккумулировано ~300 т плутония[198].

Таблетка диоксида плутония-238[~ 20].
Желто-коричневый порошок, состоящий из диоксида плутония, способен выдерживать нагревание до температуры 1200 °C. Синтез соединения происходит с помощью разложения тетрагидроксида или тетранитрата плутония в атмосфере кислорода[2]:
 .
.
Полученный порошок шоколадного цвета спекается и нагревается в токе влажного водорода до 1500 °C. При этом образуются таблетки плотностью 10,5—10,7 г/см³, которые можно использовать в качестве ядерного топлива[2]. Диоксид плутония является самым стабильным и инертным из оксидов плутония и посредством нагревания до высоких температур разлагается на составляющие, и потому применяется при переработке и хранении плутония, а также его дальнейшего использования как источника электроэнергии[199]. Один килограмм плутония эквивалентен примерно 22 млн кВт·ч тепловой энергии[198].
В СССР было произведено несколько РИТЭГов Топаз, которые были предназначены для генерации электричества для космических аппаратов. Эти аппараты были предназначены работать с плутонием-238, который является α-излучателем. После падения Советского Союза США закупили несколько таких аппаратов для изучения их устройства и дальнейшего применения в своих долговременных космических программах[200].

РИТЭГ зонда Новые Горизонты.
Вполне достойной заменой плутонию-238 можно было бы назвать полоний-210. Его тепловыделение составляет 140 Вт/г, а всего один грамм может разогреться до 500 °C. Однако из-за его чрезвычайно малого для космических миссий периода полураспада (140 сут) применение этого изотопа в космической отрасли сильно ограничено[89] (например, он был использован в каждой миссии Луноходов, а также нашел свое применение в искусственных спутниках Земли[201]).
Плутоний-238 в 2006 г. при запуске зонда New Horizons к Плутону нашел свое применение в качестве источника питания для зонда[202]. Радиоизотопный генератор содержал 11 кг высокочистого диоксида 238Pu, производившего в среднем 220 Вт электроэнергии на протяжении всего пути (240 Вт в начале пути и 200 Вт к концу)[203][204]. Высказывались опасения о неудачном запуске зонда (шанс неудачи составлял 1:350), однако он все таки состоялся. После запуска зонд развил скорость 36000 миль/ч благодаря силам гравитации Земли. В 2007 году благодаря гравитационному маневру вокруг Юпитера его скорость повысилась ещё на 9 тыс. миль (в сумме примерно 72420 км/ч, или 20,1 км/с), что позволит ему приблизиться на минимальное расстояние к Плутону в июле 2015 года и затем продолжить свое наблюдение за поясом Койпера[205][206].
Зонды Галилео и Кассини были также оборудованы источниками энергии, в основе которых лежал плутоний[207]. Изотоп будет применяться и на будущих миссиях, например марсоход Curiosity будет получать энергию благодаря плутонию-238[208]. Его спуск на поверхность Марса планируется провести в августе 2012 года[209]. Марсоход будет использовать последнее поколение РИТЭГов, называемое Multi-Mission Radioisotope Thermoelectric Generator. Это устройство будет производить 125 Вт электрической мощности, а по истечению 14 лет — 100 Вт[210]. Для работы марсохода будет производиться 2,5 кВт·ч энергии за счет распада ядер (солнечная энергия составит 0,6 кВт·ч)[211]. Плутоний-238 является оптимальным источником энергии, выделяющим 0,56 Вт·г−1. Применение этого изотопа с теллуридом свинца (PbTe), который используется в качестве термоэлектрического элемента, образует очень компактный и долговременный источник электричества без каких бы то ни было движущих частей конструкции[69], что позволяет «сэкономить» пространство космических аппаратов.

РИТЭГ SNAP-27, применявшийся в миссии Аполлон-14 (в центре).
Несколько килограммов 238PuO2 использовались не только на Галилео, но и на некоторых миссиях Аполлонов[69]. Генератор электроэнергии SNAP-27 (англ. Systems for Nuclear Auxiliary Power), тепловая и электрическая мощность которого составляла 1480 Вт и 63,5 Вт соответственно, содержал 3,735 кг диоксида плутония-238[212]. Для уменьшения риска взрыва или иных возможных происшествий, использовался бериллий в качестве термостойкого, лёгкого и прочного элемента[213]. SNAP-27 был последним типом генераторов, использовавшихся NASA для космических миссий; предыдущие типы (1, 7, 9, 11, 19, 21 и 23) использовали другие источники электроэнергии[214][215][216][217] (например, SNAP-19 был использован в миссии Пионера-10[213][218]).
При проведении пассивного сейсмического эксперимента (PSEP) на Луне в миссии Аполлон-11 были использованы два радиоизотопных тепловых источника мощностью 15 Вт, которые содержали 37,6 г диоксида плутония в виде микросфер[13]. Генератор был использован в миссиях Аполлона-12 (отмечается, что это был первый случай использования ядерной энергосистемы при полете на Луну), 14, 15, 16, 17[219]. Он был призван обеспечивать электроэнергией научное оборудование (англ. ALSEP), установленное на космических аппаратах[212]. Во время миссии Аполлона-13 произошло схождение лунного модуля с траектории, в результате чего он сгорел в плотных слоях атмосферы. Внутри SNAP-27 был использован вышеупомянутый изотоп, который окружен устойчивыми к коррозии материалами и будет храниться в них ещё 870 лет[220][221].
Плутоний-236 и плутоний-238 применяется для изготовления атомных электрических батареек, срок службы которых достигает 5 и более лет. Их применяют в генераторах тока, стимулирующих работу сердца (кардиостимулятор)[1][222]. По состоянию на 2003 г. в США было 50—100 человек, имеющих плутониевый кардиостимулятор[223]. Применение плутония-238 может распространиться на костюмы водолазов и космонавтов[22][224]. Бериллий вместе с вышеуказанным изотопом применяется как источник нейтронного излучения[37].
В 2007 г. Великобритания начала снос старейшей ядерной электростанции Calder Hall (англ.) на плутонии, которая начала свою работу 17 октября 1956 года и завершила 29 сентября 2007[225].
Реакторы-размножители

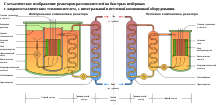
Схематическое изображение реакторов-размножителей на быстрых нейтронах с жидкометаллическим теплоносителем, с интегральной и петлевой компоновкой оборудования.
Для получения больших количеств плутония строятся реакторы-размножители («бридеры», от англ. to breed — размножать), которые позволяют нарабатывать значительные количества плутония[2]. Реакторы названы именно «размножителями» потому, что с их помощью возможно получение делящегося материала в количестве, превышающем его затраты на получение[69].
В США строительство первых реакторов данного типа началось ещё до 1950 г. В СССР и Великобритании к их созданию приступили в начале 1950 гг. Однако первые реакторы были созданы для изучения нейтронно-физических характеристик реакторов с жестким спектром нейтронов. Поэтому первые образцы должны были продемонстрировать не большие производственные количества, а возможность реализации технических решений, закладываемых в первые реакторы такого типа («Клементина», EBR-1, БР-1, БР-2)[226].
Отличие реакторов-разможителей от обычных ядерных реакторов состоит в том, что нейтроны в них не замедляются, то есть отсутствует замедлитель нейтронов (например, графит), для того, чтобы их как можно больше прореагировало с ураном-238. После реакции образуются атомы урана-239, который в дальнейшем и образует плутоний-239[200]. В таких реакторах центральная часть, содержащая диоксид плутония в обедненном диоксиде урана, окружена оболочкой из ещё более обедненного диоксида урана-238 (238UO2), в которой и образуется 239Pu. Используя вместе 238U и 235U такие реакторы могут производить из природного урана энергии в 50—60 раз больше, позволяя таким образом использовать запасы наиболее пригодных для переработки урановых руд[69]. Коэффициент воспроизводства рассчитывается отношением произведенного ядерного топлива к затраченному. Однако достижение высоких показателей воспроизводства нелегкая задача. ТВЭЛы в них должны охлаждаться чем-то отличным от воды, которая уменьшает их энергию (а чем она выше, тем больше коэффициент воспроизводства). Было предложено использование жидкого натрия в качестве охлаждающего элемента. В реакторах-размножителях используют обогащенный более 15 % по массе уран-235, для достижения необходимого нейтронного облучения и коэффициента воспроизводства примерно 1—1,2[200].
В настоящее время экономически более выгодно получение урана из урановой руды, обогащенной до 3 % ураном-235, чем размножение урана в плутоний-239 с применением урана-235, обогащенного на 15 %[200]. Проще говоря, преимуществом бридеров является способность в процессе работы не только производить электроэнергию, но и утилизировать непригодный в качестве ядерного горючего уран-238[227].
Плутоний в художественных произведениях
- Плутоний использовался в фильме Назад в будущее как топливо для реактора, с помощью которого развивалась необходимая мощность (1,21 ГВт).
- Из плутония состоял заряд атомной бомбы, взорванной террористами в Денвере, США, в произведении Тома Клэнси «Все страхи мира»
- Кэндзабуро Оэ «Записки пинчранера»
- В 2006 году компанией «Beacon Pictures» был выпущен фильм Плутоний-239 (англ.)[228].
- В серии «Fat Man and Little Boy» телесериала Симпсоны, Гомер крадёт плутоний, чтобы помочь Лизе соорудить ядерный реактор.
См. также
Примечания
Комментарии
- ↑ По утверждению источника в природе нету таких элементов с количеством протонов в ядре атома превышающем число 92, то есть, тяжелее урана. Более тяжелые элементы, например, плутоний, могут нарабатываться в ядерных реакторах, однако элементы тяжелее фермия можно получить только на ускорителях путем бомбардировок мишени тяжелыми ионами.
Ученые в России синтезировали 117-й химический элемент (рус.). BBC. Русская служба (7 апреля 2010). Архивировано из первоисточника 23 августа 2011. Проверено 3 декабря 2010. - ↑ Отношение
 . См. раздел нахождение в природе.
. См. раздел нахождение в природе. - ↑ Для того, чтобы считать новый химический элемент открытым, следовало доказать, что он обладает новыми свойствами: как физическими, так и химическими. Предположения о свойствах плутония высказывались ещё в мае 1940 года Льюисом Тернером
- ↑ С 24 августа 2006 года по решению Международного астрономического союза Плутон более не является планетой Солнечной системы
- ↑ По сообщению источника, во время интервью Сиборг сказал: «Очевидным выбором для меня были две буквы Pl, однако я в шутку предложил обозначить элемент Pu, как иногда дети кричат „Pee-yoo!“, когда кто-то плохо пахнет.» Сиборг считал, что именно Pl будет принято в качестве обозначения плутония, однако комитет выбрал Pu
David L. Clark Reflections on the Legacy of a Legend: Glenn T. Seaborg, 1912—1999. — Журнал Los Alamos Science, 2000. — В. 26. — С. 56—61, 57. - ↑ Применение взрывчатых линз, которые имели форму футбольного мяча, внутри которого, условно, находился плутониевый заряд, позволяло достичь увеличения мощности взрыва. Чем равномернее со всех сторон сжимался ядерный заряд, тем мощнее был ядерный взрыв.
- ↑ По сообщению источника латунная ампула, на которой располагается бериллий и полоний, диаметром в 2 и высотой 4 см позволяет достичь выхода 90 млн нейтронов в секунду.
В. В. Станцо Полоний (рус.). «Всякая всячина» — wsyachina.com. Архивировано из первоисточника 23 августа 2011. Проверено 7 января 2011. - ↑ Соединение гадолиния и циркония с кислородом (Gd2Zr2O7) было создано в связи с тем, что оно позволяет удерживать плутоний на протяжении 30 млн лет.
- ↑ Плутоний находится в пакете для того, что бы предотвратить альфа-излучение и, возможно, для термоизоляции.
- ↑ Температура кипения плутония в пять раз больше температуры плавления. Для сравнения: у вольфрама этот показатель составляет 1,6 (темп. плавления 3422 °C и кипения 5555 °C).
- ↑ Данный эффект связан с тем, что кислород, реагируя с плутонием и образуя смешанные оксиды на поверхности плутония, препятствует к коррозии плутония, по крайней мере снаружи. Аргон не реагирует с плутонием и одновременно препятствует химическим реакциям плутония, в итоге его поверхность ничем не пассивирована и подвергается коррозии вследствие саморазогрева.
- ↑ Амплитуда колебаний показателей плотности плутония составляет 4 г/см³ (точнее: 3,94 г/см³).
- ↑ PuO2+ ион нестабильный в водном растворе и может диспропорционировать в Pu4+ и PuO22+; Pu4+ затем может окислиться с PuO2+ до PuO22+, будучи ионом Pu3+. Таким образом, с течением времени водные растворы Pu3+ могут соединяться с кислородом образуя оксид PuO22+
Crooks, William J. Nuclear Criticality Safety Engineering Training Module 10 — Criticality Safety in Material Processing Operations, Part 1 (2002). Архивировано из первоисточника 23 августа 2011. Проверено 5 сентября 2010. - ↑ Предполагается, что у церия валентность равна 3,6
- ↑ δ-фаза стабилизируется при комнатной температуре растворением 2 ат.% Ga
- ↑ δ-фаза остается при комнатной температуре в метастабильном состоянии, если растворить 1 ат.% Ga и быстро охладить
- ↑ Следует учитывать, что выработка наиболее оптимальной конструкции ядерной бомбы вырабатывалась годами.
- ↑ Образец.
- ↑ Однако эта цифра сильно разнится. Из этого количества плутоний можно получить в сотни раз меньших количествах.
- ↑ Остальные изотопы имеют чрезвычайно малые показатели тепловыделения по сравнению с 238Pu, и потому не применяются в качестве источника энергии. См. таблицу в разделе свойства некоторых изотопов.
Источники
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 Дриц М. Е. и др. Свойства элементов. — Справочник. — М.: Металлургия, 1985. — 672 с. — 6500 экз.
- ↑ 1 2 3 4 5 Неорганическая химия в трёх томах / Под ред. Ю. Д. Третьякова. — М.: Издательский центр «Академия», 2007. — Т. 3. — 400 с. — (Химия переходных элементов). — 3000 экз. — ISBN 5-7695-2533-9
- ↑ Plutonium (англ.). AmericanElements.com. Архивировано из первоисточника 23 августа 2011. Проверено 11 января 2011.
- ↑ 1 2 3 4 5 Плутоний — статья из Физической энциклопедии
- ↑ 1 2 3 Радиоактивные вещества / Под общ. ред. акад. АМН СССР Ильина Л. А. и др. — Справ. изд. — Л.: "Химия", 1990. — 464 с. — (Вредные химические вещества). — 35 150 экз. — ISBN 5-7245-0216-X
- ↑ 1 2 Plutonium: the essentials (англ.). WebElements. Проверено 29 декабря 2010.
- ↑ 1 2 3 4 Мед—Пол // Химическая энциклопедия / Глав. ред. И. Л. Кнунянц. — М.: Большая Российкая Энциклопедия, 1992. — Т. 3. — С. 580. — 639 с. — (Химическая энциклопедия в 5ти томах). — 50 000 экз. — ISBN 5-85270-039-8
- ↑ David R. Lide. Vapor Pressure // CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data. — 90-е изд. — Taylor and Francis, 2009. — С. 6-77. — 2828 с. — ISBN 1420090844, 9781420090840
- ↑ Plutonium: crystal structure (англ.). Проверено 25 августа 2010.
- ↑ 1 2 3 4 5 6 7 8 Милюкова М. С., Гусев Н. И., Сентюрин И. Г., Скляренко И. С. Аналитическая химия плутония. — М.: "Наука", 1965. — 447 с. — (Аналитическая химия элементов). — 3400 экз.
- ↑ 1 2 3 Plutonium (англ.). Human Health Fact Sheet. Argonne National Laboratory (август 2005). Архивировано из первоисточника 23 августа 2011. Проверено 21 ноября 2010.
- ↑ 1 2 3 Richard D. Baker Plutonium: A Wartime Nightmare but a Metallurgist's Dream // Соавт.: Hecker, Siegfried S.; Harbur, Delbert R. Los Alamos Science. — Los Alamos National Laboratory, 1983. — С. 148, 150—151.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 Ф. Вайгель, Дж. Кац, Г. Сиборг и др. Химия актиноидов = The Chemistry of the Actinide Elements / Пер. с англ. под ред. Дж. Каца, Г. Сиборга, Л. Морсса. — Москва: «Мир», 1997. — Т. 2. — 664 с. — (Химия актиноидов). — 500 экз. — ISBN 5-03-001885-9
- ↑ 1 2 Плутоний (рус.). allmetals.ru. Архивировано из первоисточника 23 августа 2011. Проверено 26 ноября 2010.
- ↑ Uncovering the Secrets of Actinides (англ.) (pdf). Actinides Can Mean Nuclear Chemistry 17. Lawrence Livermore National Laboratory (июнь 2000). Проверено 22 марта 2011.
- ↑ 1 2 3 4 5 6 Плутоний // Серебро—Нильсборий и далее / Ред.: Петрянов-Соколов И. В. — 3-е изд. — М.: "Наука", 1983. — Т. 2. — 570 с. — (Популярная библиотека химических элементов). — 50 000 экз.
- ↑ Transuranium element — статья из Энциклопедии Британника
- ↑ Edwin McMillan, Philip Hauge Abelson Radioactive Element 93 (англ.) // Phys. Rev : статья. — American Physical Society, 1940. — В. 57. — № 12. — С. 1185—1186. — DOI:10.1103/PhysRev.57.1185.2
- ↑ Gregory R. Choppin, Jan-Olov Liljenzin, Jan Rydberg. Radiochemistry and Nuclear Chemistry. — 3-е изд. — Butterworth-Heinemann, 2002. — 709 с. — ISBN 0750674636, 9780750674638
- ↑ Glenn T. Seaborg The Transuranium Elements (англ.) // Журнал Science : статья. — 25 октября 1946. — В. 104. — № 2704. — С. 379—386. — DOI:10.1126/science.104.2704.379 — PMID 17842184.
- ↑ 1 2 Пирометаллургия—С // Краткая химическая энциклопедия / Глав. ред.: И. Л. Кнунянц и др. — М.: "Советская энциклопедия", 1965. — Т. 4. — С. 90—92. — 1182 с. — (Энциклопедии. Словари. Справочники). — 81 000 экз.
- ↑ 1 2 3 А. М. Голуб. Общая и неорганическая химия = Загальна та неорганична хiмiя. — Киев: Вища школа, 1971. — Т. 2. — 416 с. — 6700 экз.
- ↑ Plutonium Element Facts (англ.). Abundance & Isotopes. chemicool.com. Архивировано из первоисточника 23 августа 2011. Проверено 29 декабря 2010.
- ↑ 1 2 Тимошенко, Алексей. Обама открыл «частникам» дорогу в космос (рус.), gzt.ru (12 октября 2010). Проверено 22 октября 2010.
- ↑ 1 2 Аркадий Круглов Американцы заплатили за уничтожение плутония (рус.) // Газета Коммерсантъ : статья. — Томск: Коммерсантъ, 2003. — В. 2753. — № 150.
- ↑ Holden, Norman E. A Short History of Nuclear Data and Its Evaluation (англ.). 51st Meeting of the USDOE Cross Section Evaluation Working Group. Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory (2001). Архивировано из первоисточника 23 августа 2011. Проверено 11 сентября 2010.
- ↑ Fermi, Enrico Artificial radioactivity produced by neutron bombardment: Nobel Lecture (англ.). Royal Swedish Academy of Sciences (12 декабря 1938). Архивировано из первоисточника 23 августа 2011. Проверено 11 сентября 2010.
- ↑ Darden, Lindley. Enrico Fermi: "Transuranium" Elements, Slow Neutrons // The Nature of Scientific Inquiry. — College Park (MD): Department of Philosophy, University of Maryland, 1998.
- ↑ Кудрявцев П. С. Курс истории физики. — М.: Просвещение, 1982. — С. 70. — 448 с.
- ↑ Michael McClure The New Alchemy. The Search Went On... (англ.) // Журнал ChemMatters : статья. — American Chemical Society (ACS), октябрь 2006. — С. 17.
- ↑ Алексей Левин Хассий-долгожитель (рус.). Элементы.Ру (19 декабря 2006). Архивировано из первоисточника 23 августа 2011. Проверено 27 декабря 2010.
- ↑ The Nobel Prize in Chemistry 1951 (англ.). NobelPrize.org (2 января 2011). Архивировано из первоисточника 23 августа 2011. Проверено 2 января 2011.
- ↑ 1 2 3 Boris E. Burakov, Michael I. Ojovan, William (Bill) E. Lee. Introdution to the Actinides // Crystalline Materials for Actinide Immobilisation. — World Scientific Publishing Company, Inc, 2010. — Т. 1. — 197 с. — ISBN 1848164181, 9781848164185
- ↑ Edwin M. McMillan The transuranium elements: early history (англ.) (pdf). Nobel Lecture (12 декабря 1951). Архивировано из первоисточника 23 августа 2011. Проверено 24 декабря 2010.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Бекман И. Н. Плутоний. — Учебное пособие. — М.: МГУ им. М. В. Ломоносова, 2009.
- ↑ 1 2 3 National Research Council (U.S.). Subcommittee on Nuclear and Radiochemistry. A Review of the accomplishments and promise of U.S. transplutonium research, 1940–1981. — National Academies, 1982. — 83 с.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 John, Emsley. Plutonium // Nature's Building Blocks: An A—Z Guide to the Elements. — Oxford: Oxford University Press, 2003. — 538 с. — ISBN 0198503407, 9780198503408
- ↑ Wahl, professor who discovered plutonium; 89 (англ.). Newsroom. Washington University in St. Louis (27 апреля 2006). Архивировано из первоисточника 23 августа 2011. Проверено 13 января 2011.
- ↑ Joseph W. Kennedy (англ.). Staff Biographies. Los Alamos National Laboratory. Архивировано из первоисточника 23 августа 2011. Проверено 13 января 2011.
- ↑ Glenn T. Seaborg The Plutonium Story (англ.). Lawrence Berkeley Laboratory, University of California. Архивировано из первоисточника 23 августа 2011. Проверено 2 декабря 2010.
- ↑ Gerhart Friedlander, Alfred M. Holtzer, Demetrios G. Sarantites, Lee G. Sobotka, Samual I. Weissman Arthur C. Wahl (англ.). Death notice. Physics Today (11 июля 2006).(недоступная ссылка — история) Проверено 13 января 2011.
- ↑ Seaborg, G. T. The Transuranium Elements (англ.) // Katz, J. J., and Manning, W. M. (eds) Natl Nucl. En. Ser., Div IV, 14B : статья. — New-York: McGraw-Hill, 1949. — С. 1.2, 5.
- ↑ Scott F. A., Peekema R. M. Progress in Nuclear Energy. — 1-е изд. — London: Pergamon Press, 1959. — С. 65.
- ↑ 1 2 Albert Stwertka. Plutonium // Guide to the Elements. — Oxford: Oxford University Press, 1998. — ISBN 0-19-508083-1
- ↑ 1 2 3 4 Glenn T. Seaborg. Modern alchemy: selected papers of Glenn T. Seaborg. — World Scientific, 1994. — 696 с.
- ↑ Гребеников Е. А., Рябов Ю. А. Открытие Плутона // Поиски и открытия планет. — 2-е изд., перераб. и доп. — М.: "Наука", 1984. — С. 156—162. — 224 с. — 100 000 экз.
- ↑ Rincon, Paul The girl who named a planet (англ.). BBC News (13 января 2006). Архивировано из первоисточника 23 августа 2011. Проверено 7 ноября 2010.
- ↑ Plutonium (англ.). History & Etymology. Elementymology & Elements Multidict. Архивировано из первоисточника 23 августа 2011. Проверено 14 января 2011.
- ↑ 1 2 PBS contributors Frontline interview with Seaborg (англ.). Frontline. Public Broadcasting Service (1997). Архивировано из первоисточника 5 января 2009. Проверено 11 сентября 2010.
- ↑ 1 2 Химический факультет МГУ Плутоний, Plutonium, Pu (94) (рус.). Открытие элементов и происхождение их названий. МГУ. Архивировано из первоисточника 23 августа 2011. Проверено 9 ноября 2010.
- ↑ 1 2 3 4 5 6 7 Heiserman, David L. Element 94: Plutonium // Exploring Chemical Elements and their Compounds. — New York: TAB Books, 1992. — С. 337—340. — ISBN 0-8306-3018-X
- ↑ David L. Clark Reflections on the Legacy of a Legend: Glenn T. Seaborg, 1912—1999. — Журнал Los Alamos Science, 2000. — В. 26. — С. 56—61, 57.
- ↑ NPS contributors Room 405, George Herbert Jones Laboratory (англ.). National Park Service. Архивировано из первоисточника 23 августа 2011. Проверено 11 сентября 2010.
- ↑ Cunningham, B. B. and Werner, L. B. The Transuranium Elements (англ.) // Ред. кол.: G. T. Seaborg, J. J. Katz, W. M. Manning Natl Nucl. En. Ser., Div IV, 14B : статья. — New-York: McGraw-Hill, 1949. — С. 1.8, 51.
- ↑ Seaborg, G. T. History of Met Lab Section C1 (англ.) // Report P-112 : статья. — 1942—1943. — В. 1.
- ↑ Glenn T. Seaborg и др. The First Weighing of Plutonium (англ.) (pdf) vi. United States Atomic Energy Comission. University of Chicago (10 сентября 1967). Архивировано из первоисточника 23 августа 2011. Проверено 13 января 2011.
- ↑ Thompson's Process (англ.). The University of California (16 октября 2006). Архивировано из первоисточника 23 августа 2011. Проверено 16 декабря 2010.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 William N. Miner. The Encyclopedia of the Chemical Elements / Под ред. Clifford A. Hampel; соавт. Schonfeld, Fred W. — New York: Reinhold Book Corporation, 1968.
- ↑ 1 2 3 4 5 6 Большая советская энциклопедия Плутоний (рус.). Яндекс.Словари. Архивировано из первоисточника 23 августа 2011. Проверено 15 октября 2010.
- ↑ История создания первой в СССР радиохимической технологии получения плутония (рус.) (pdf). Радиевый институт им. В. Г Хлопина. Архивировано из первоисточника 23 августа 2011. Проверено 2 января 2011.
- ↑ Ковалева, С. Плутоний в девичьих руках: cоздательницы «ядерного щита» Родины работали без страховки и отпусков (рус.) // Независимая газета : статья. — 14 октября 1997. — С. 6.
- ↑ 1 2 Ефимова, Мария MI5 обнаружила советского шпиона среди Нобелевских лауреатов (рус.). gzt.ru (26 августа 2010). Архивировано из первоисточника 4 ноября 2012. Проверено 22 октября 2010.
- ↑ Einstein's Letter to Franklin D. Roosevelt (англ.) (pdf). The Atomic Heritage Foundation. Архивировано из первоисточника 23 августа 2011. Проверено 24 декабря 2010.
- ↑ Pa, this requires action! (англ.) (pdf). The Atomic Heritage Foundation. Архивировано из первоисточника 23 августа 2011. Проверено 24 декабря 2010.
- ↑ Vincent C. Jones. Manhattan, the Army and the Atomic Bomb / В соавт. с Center of Military History (U.S. Army). — Вашингтон: Government Printing Office, 1985. — 680 с. — ISBN 0160019397, 9780160019395
- ↑ LANL contributors Site Selection (англ.). LANL History. Los Alamos, New Mexico: Los Alamos National Laboratory. Архивировано из первоисточника 23 августа 2011. Проверено 11 сентября 2010.
- ↑ Site of the First Self-Sustaining Nuclear Reaction (англ.). National Historic Landmark summary listing. National Park Service. Архивировано из первоисточника 23 августа 2011. Проверено 24 декабря 2010.
- ↑ Hans A. Bethe The German Uranium Project (англ.) // Physics Today : статья. — Physics Today Online, июль 2000. — В. 53. — № 7. — DOI:10.1063/1.1292473
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 Гринвуд Н. Н., Эрншо А. Химия элементов = Chemistry of the elements / Пер. с англ. ред. кол. — Учебное пособие. — М.: Бином. Лаборатория знаний, 2008. — Т. 2. — 607 с. — (Лучший зарубежный учебник. В 2-х томах). — 2000 экз. — ISBN 978-5-94774-373-9
- ↑ CP-1 Goes Critical (англ.). The Manhattan Project. An Interactive History. US DOE. Office of History and Heritage Resources.(недоступная ссылка — история) Проверено 24 декабря 2010.
- ↑ Final Reactor Design and X-10 (англ.). The Manhattan Project. An Interactive History. US DOE. Office of History and Heritage Resources.(недоступная ссылка — история) Проверено 1 января 2011.
- ↑ ORNL Metals and Ceramics Division, History 1946—1996 (англ.) (pdf). Oak Ridge National Laboratory (8 марта 1999). — 154 стр. Архивировано из первоисточника 23 августа 2011. Проверено 23 декабря 2010.
- ↑ 1 2 X-10 (англ.). The Tennessee Encyclopedia of History and Science (2002).(недоступная ссылка — история) Проверено 23 декабря 2010.
- ↑ Oak Ridge National Laboratory (англ.). The Tennessee Encyclopedia of History and Science (2002).(недоступная ссылка — история) Проверено 24 декабря 2010.
- ↑ Carey Sublette Atomic History Timeline 1942—1944 (англ.). Washington (DC): Atomic Heritage Foundation. Проверено 11 сентября 2010.
- ↑ 1 2 F. G. Gosling. Elimination of Thin Man // The Manhattan Project: making the atomic bomb. — DIANE Publishing, 1999. — С. 40. — 66 с. — ISBN 0788178806, 9780788178801
- ↑ B Reactor (англ.). U.S. Department of Energy.(недоступная ссылка — история) Проверено 1 января 2011.
- ↑ Michele S. Gerber, Brian Casserly, Frederick L. Brown B Reactor (англ.) (pdf) 4. National Historic Landmark Nomination (февраль 2007). Архивировано из первоисточника 23 августа 2011. Проверено 1 января 2011.
- ↑ Американцы проложили туристический маршрут через старый ядерный реактор (рус.). Lenta.Ru (24 сентября 2007). Архивировано из первоисточника 23 августа 2011. Проверено 18 ноября 2010.
- ↑ 1 2 Hanford Site Cleanup Completion Framework (англ.) (pdf). Department of Enegry. Hanford (июль 2010). — Более подробное описание районов можно найти в главе 2.3.1. Архивировано из первоисточника 23 августа 2011. Проверено 7 ноября 2010.
- ↑ Long-Range Deep Vadose Zone Program Plan (англ.) (pdf). Department of Enegry. Hanford (октябрь 2010). Архивировано из первоисточника 23 августа 2011. Проверено 7 ноября 2010.
- ↑ Historic Sample Of Bomb-Grade Plutonium Discovered (англ.). ScienceDaily Online (5 марта 2009). Архивировано из первоисточника 23 августа 2011. Проверено 25 декабря 2010.
- ↑ Rincon, Paul. BBC NEWS — Science & Environment — US nuclear relic found in bottle, BBC News (2 марта 2009). Проверено 11 сентября 2010.
- ↑ Erika Gebel Old plutonium, new tricks. — Журнал Analytical Chemistry, 2009. — В. 81. — № 5. — С. 1724. — DOI:10.1021/ac900093b
- ↑ Jon M. Schwantes Nuclear archeology in a bottle: Evidence of pre-Trinity U.S. weapons activities from a waste burial site. — Журнал Analytical Chemistry, 2009. — В. 81. — № 4. — С. 1297—1306. — DOI:10.1021/ac802286a — PMID 19152306.
- ↑ Вести ФМ. Работа по созданию атомной бомбы была сделана удивительно быстро и качественно. История с Андреем Светенко (рус.), Вести.Ру (16 июля 2010). Проверено 29 октября 2010.
- ↑ A. J. Fahey, C. J. Zeissler, D. E. Newbury, J. Davis, and R. M. Lindstrom Postdetonation nuclear debris for attribution (англ.). — Proceedings of the National Academy of Sciences of the United States of America, 2010. — DOI:10.1073/pnas.1010631107
- ↑ Испытание первого в мире атомного устройства. Справка (рус.). РИА Новости (16 июля 2010). — Материал подготовлен на основе информации открытых источников. Архивировано из первоисточника 23 августа 2011. Проверено 4 декабря 2010.
- ↑ 1 2 Polonium (англ.) (pdf). Human Health Fact Sheet. Aragonne National Laboratory (август 2005). Архивировано из первоисточника 23 августа 2011. Проверено 22 декабря 2010.
- ↑ Sublette, Carey 8.1.1 The Design of Gadget, Fat Man, and «Joe 1» (RDS-1) (англ.). Nuclear Weapons Frequently Asked Questions, edition 2.18. The Nuclear Weapon Archive (3 July 2007). Архивировано из первоисточника 23 августа 2011. Проверено 17 сентября 2010.
- ↑ Лесли Гровс. Выбор цели // Теперь об этом можно рассказать. История Манхэттенского проекта = Now it can be told. The story of Manhattan project. — М.: Атомиздат, 1964.
- ↑ John Malik. The Yields of the Hiroshima and Nagasaki Explosions. — Los Alamos: Los Alamos, 1985. — Таблица VI.
- ↑ Валерий Чумаков Мирный фатум (рус.) // Журнал «Вокруг Света» : статья. — «Вокруг Света», 2009. — В. 2831. — № 12.
- ↑ DOE contributors. Historic American Engineering Record: B Reactor (105-B Building). — Richland (WA): U.S. Department of Energy. — С. 110.
- ↑ Cochran, Thomas B. "Safeguarding nuclear weapons-usable materials in Russia" in International Forum on Illegal Nuclear Traffic., Washington (DC): Natural Resources Defense Council, Inc. Проверено 17 сентября 2010.
- ↑ 1 2 3 4 CRC contributors. Handbook of Chemistry and Physics / Ред.: David R. Lide. — 87-е изд. — Boca Raton: CRC Press, Taylor & Francis Group, 2006. — ISBN 0849304873
- ↑ Stockholm International Peace Research Institute. SIPRI Yearbook 2007: Armaments, Disarmament, and International Security. — Oxford University Press, 2007. — С. 567. — ISBN 0199230218, 9780199230211
- ↑ Department of Energy Files Motion to Withdraw Yucca Mountain License Application (англ.). Department of Energy (DOE) (3 марта 2010).(недоступная ссылка — история) Проверено 20 декабря 2010.
- ↑ 1 2 3 Moss, William The Human Plutonium Injection Experiments (англ.) // Eckhardt, Roger Журнал Los Alamos Science. — Los Alamos National Laboratory, 1995. — В. 23. — С. 188, 205, 208, 214.
- ↑ 1 2 George L., Voelz Plutonium and Health: How great is the risk? (англ.) // Журнал Los Alamos Science. — Los Alamos (NM): Los Alamos National Laboratory, 2000. — № 26. — С. 78—79.
- ↑ 1 2 Плутоний = Plutonium Handbook. A Guide to the Technology / Перев. с англ. Под ред. В. Б. Шевченко и В. К. Маркова. — Справочник. — М.: Атомиздат, 1971. — Т. 1. — С. 12. — 428 с. — 2260 экз.
- ↑ 1 2 3 4 5 NIH contributors Plutonium, Radioactive (англ.). Bethesda (MD): U.S. National Library of Medicine, National Institutes of Health. — Wireless Information System for Emergency Responders (WISER). Архивировано из первоисточника 23 августа 2011. Проверено 4 сентября 2010.
- ↑ ARQ staff Nitric acid processing (англ.) // Actinide Research Quarterly. — Los Alamos (NM): Los Alamos National Laboratory, 2008. Проверено 4 сентября 2010.
- ↑ 1 2 3 4 5 Пер. с англ. языка под ред. Б. А. Надыкто и Л. Ф. Тимофеевой. Плутоний. — Саров: РФЯЦ-ВНИИЭФ, 2003. — Т. 2. — 203 с. — (Фундаментальные проблемы). — 500 экз. — ISBN 5-9515-00-24-9
- ↑ Taking Stock: A Look At The Opportunities And Challenges Posed By Inventories From The Cold War Era. — 1-е изд. — DIANE Publishing Company, 2004. — 190 с. — ISBN 0788138081, 9780788138089
- ↑ 1 2 3 Kolman, D. G. and Colletti, L. P. ECS transactions (англ.) // 16-е изд. — Electrochemical Society, 2009. — В. 52. — С. 71. — ISSN 1938-5862.
- ↑ 1 2 3 NNDC contributors; Alejandro A. Sonzogni (Database Manager) Chart of Nuclides (англ.). Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory (2008). Архивировано из первоисточника 23 августа 2011. Проверено 4 сентября 2010.
- ↑ Richard Rhodes. The Making of the Atomic Bomb. — New York: Simon & Schuster, 1986. — С. 659—660. — ISBN 0-671-65719-4
- ↑ 1 2 3 4 5 6 7 Siegfried S. Hecker Plutonium and its alloys: from atoms to microstructure // 26-е изд. — Los Alamos Science, 2000. — С. 290—335.
- ↑ Wick, O. J. (ed.) Plutonium handbook, A Guide to the Technology / Am. Nucl. Soc. — Reprint. — New York: Gordon & Breach, 1980.
- ↑ Oetting, F. L., Rand, M. H., Ackerman, R. J. The Chemical Thermodynamics of Actinide Elements and their Compounds. — Ч. 1. — Vienna: IAEA, 1976. — С. 24.
- ↑ 1 2 3 4 Александр Прищепенко Дамоклов меч: Атомная бомба (рус.) // Популярная механика : статья. — январь 2009.
- ↑ Plutonium Crystal Phase Transitions (англ.), GlobalSecurity.org. Проверено 5 сентября 2010.
- ↑ Актиноиды — статья из Физической энциклопедии
- ↑ Нептуний (рус.). Нептуний и плутоний – семивалентные. Популярная библиотека химических элементов (27 сентября 2003). Архивировано из первоисточника 23 августа 2011. Проверено 11 декабря 2010.
- ↑ George, Matlack. A Plutonium Primer: An Introduction to Plutonium Chemistry and its Radioactivity. — Los Alamos National Laboratory, 2002.
- ↑ 1 2 3 4 5 6 Rita Cornelis, Joe Caruso, Helen Crews, Klaus Heumann. Handbook of elemental speciation II: species in the environment, food, medicine & occupational health. — Перепечатанное и иллюстрированное. — John Wiley and Sons, 2005. — 768 с. — ISBN 0470855983, 9780470855980
- ↑ 1 2 3 Dumé, Belle. Plutonium is also a superconductor (англ.), PhysicsWeb.org (November 20, 2002). Проверено 5 сентября 2010.
- ↑ Mary, Eagleson. Concise Encyclopedia Chemistry. — Walter de Gruyter, 1994. — С. 840. — ISBN 9783110114515
- ↑ Cleveland, J. M. Ind. Eng. Chem. Process Des. Dev. (англ.). — 1965. — № 4. — С. 230.
- ↑ Cleveland, J. M. J. Inorg. Nucl. Chem. (англ.). — 1964. — № 26. — С. 461—467.
- ↑ Jenkis, W. J. J. Inorg. Nucl. Chem. (англ.). — 1963. — № 25. — С. 463—464.
- ↑ Плутоний (рус.). БСЭ. Архивировано из первоисточника 4 ноября 2012. Проверено 21 октября 2010.
- ↑ Crooks, W. J. и др. Low Temperature Reaction of ReillexTM HPQ and Nitric Acid. — 20-е изд. — Solvent Extraction and Ion Exchange, 2002. — С. 543.
- ↑ DOE contributors Oklo: Natural Nuclear Reactors. U.S. Department of Energy, Office of Civilian Radioactive Waste Management (2004).(недоступная ссылка — история) Проверено 7 сентября 2010.
- ↑ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. Detection of Plutonium-244 in Nature (англ.) // Журнал Nature : статья. — 1971. — В. 234. — С. 132—134. — DOI:10.1038/234132a0
- ↑ David Curtis. Nature's uncommon elements: plutonium and technetium / Fabryka-Martin, June; Paul, Dixon; Cramer, Jan. — 63. — Журнал «Geochimica et Cosmochimica Acta», 1999. — С. 275—285.
- ↑ D. C. Hoffman Detection of Plutonium-244 in Nature // 34 / Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M.. — Журнал «Nature», 1971. — В. 234. — С. 132—134.
- ↑ Peterson, Ivars Uranium displays rare type of radioactivity (англ.). Science News (7 декабря 1991). Проверено 7 сентября 2010.
- ↑ Волков В. А. и др. Выдающиеся химики мира / Под. ред. проф. Кузнецова В. И. — Биографический справочник. — М.: Высшая школа, 1991. — С. 407. — 656 с. — 100 000 экз. — ISBN 5-06-001568-8
- ↑ EPA contributors Fissile Material. Radiation Glossary. United States Environmental Protection Agency (2008). Архивировано из первоисточника 23 августа 2011. Проверено 5 сентября 2010.
- ↑ G. Audi, O. Bersillon, J. Blachnot, A. H. Wapstra The Nubase evaluation of nuclear and decay properties (англ.) (pdf). Nuclear Physics (2003). — Таблица с описанием ядерных свойств изотопов и периодами их полураспада. Архивировано из первоисточника 23 августа 2011. Проверено 9 ноября 2010.
- ↑ 94-plutonium (англ.). Korea Atomic Energy Research Institute (2002). Архивировано из первоисточника 23 августа 2011. Проверено 28 декабря 2010.
- ↑ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra The Nubase evaluation of nuclear and decay properties (англ.) // Журнал Nuclear Physics : статья. — 2003. — В. 128. — С. 3—128.
- ↑ 1 2 Таблица нуклидов МАГАТЭ (англ.). International Atomic Energy Agency. Архивировано из первоисточника 6 февраля 2011. Проверено 28 октября 2010.
- ↑ 1 2 3 4 5 David Albright, Frans Berkhout, William Walker, Stockholm International Peace Research Institute. World inventory of plutonium and highly enriched uranium. — Oxford University Press, 1993. — 246 с. — ISBN 0198291531, 9780198291534
- ↑ 1 2 У плутония-237 основным каналом распада является электронный захват, однако обнаружен также менее вероятный канал альфа-распада. У плутония-241 основным каналом распада является бета-минус-распад, однако обнаружены также менее вероятные каналы альфа-распада и спонтанного деления.
- ↑ J. W. Kennedy. Properties of Element 94 / Соавт.: Seaborg, G. T.; Segrè, E.; Wahl, A. C. — 70-е изд. — Physical Review, 1946. — С. 555—556.
- ↑ N. N. Greenwood. Chemistry of the Elements / Соавт.: Earnshaw, A. — 2-е изд. — Oxford: Butterworth-Heinemann, 1997. — ISBN 0-7506-3365-4
- ↑ Roger Case и др. Environmental monitoring for nuclear safeguards. — DIANE Publishing, 1995. — 45 с. — ISBN 1428920137, 9781428920132
- ↑ 1 2 Can Reactor Grade Plutonium Produce Nuclear Fission Weapons? (англ.). Council for Nuclear Fuel Cycle Institute for Energy Economics, Japan (2001). Архивировано из первоисточника 23 августа 2011. Проверено 5 сентября 2010.
- ↑ 1 2 3 4 John Holdren; Matthew Bunn Types of Nuclear Bombs, and the Difficulty of Making Them (англ.). Nuclear Threat Initiative (25 ноября 2002). Архивировано из первоисточника 3 февраля 2012. Проверено 23 ноября 2010.
- ↑ Final Report, Evaluation of nuclear criticality safety data and limits for actinides in transport (англ.) (pdf). Institut de Radioprotection et de Sûreté Nucléaire. Архивировано из первоисточника 23 августа 2011. Проверено 23 ноября 2010.
- ↑ Troubles tomorrow? Separated Neptunium 237 and Americium (англ.). Часть V. ISIS (1999). Архивировано из первоисточника 23 августа 2011. Проверено 23 ноября 2010.
- ↑ 1 2 A. Blanchard; K. R. Yates; J. F. Zino; D. Biswas; D. E. Carlson; H. Hoang; D. Heemstra Updated Critical Mass Estimates for Plutonium-238 (англ.). U.S. Department of Energy: Office of Scientific & Technical Information. Архивировано из первоисточника 23 августа 2011. Проверено 23 ноября 2010.
- ↑ 1 2 Amory B. Lovins Nuclear weapons and power-reactor plutonium (англ.) // Журнал Nature : статья. — 1980. — В. 283. — № 5750. — С. 817—823. — DOI:10.1038/283817a0
- ↑ 1 2 3 4 5 6 7 Плутоний (рус.). nuclear-weapons.nm.ru (2002). Архивировано из первоисточника 23 августа 2011. Проверено 13 ноября 2010.
- ↑ NMT Division Recycles, Purifies Plutonium-238 Oxide Fuel for Future Space Missions (англ.). Los Alamos National Laboratory (LANL) (26 июня 1996). Архивировано из первоисточника 23 августа 2011. Проверено 22 декабря 2010.
- ↑ Allen, R. P., Dahlgren, S. D., and Way, R. ref. 321 (англ.). — 1976. — С. 61.
- ↑ Bush, R. A. ref. 320 (англ.). — 1970. — С. 1037, 1045.
- ↑ Elliot, R. O., Geissen, B. C. ref. 321 (англ.). — 1976. — С. 47.
- ↑ Moody, Kenton James; Hutcheon, Ian D.; Grant, Patrick M. "plutonium+alloys"&cd=22#v=onepage&q=%22plutonium%20alloys%22 Nuclear forensic analysis. — CRC Press, 2005. — С. 169. — ISBN 0849315131
- ↑ Hurst, D. G. and Ward, A. G. Canadian Research Reactors. — Los Alamos National Laboratory.
- ↑ Curro, N. J. Unconventional superconductivity in PuCoGa5. — Los Alamos National Laboratory, 2006.
- ↑ McCuaig, Franklin D. Pu-Zr alloy for high-temperature foil-type fuel. — 1977.
- ↑ Jha, D.K. Nuclear Energy. — Discovery Publishing House, 2004. — С. 73. — ISBN 8171418848
- ↑ 1 2 3 Plutonium / Авт. колл. — Taylor & Francis, 1967. — 1114 с.
- ↑ 1 2 3 4 Пер. с англ. языка под ред. Б. А. Надыкто и Л. Ф. Тимофеевой. Плутоний. — Саров: РФЯЦ-ВНИИЭФ, 2003. — Т. 1. — 292 с. — (Фундаментальные проблемы). — 500 экз. — ISBN 5-9515-00-24-9
- ↑ Prof. Dr. Paraskev Stoyanov Scripta Scientifica Medica (англ.) // Medical University : статья. — Варна, Болгария, 2010. — В. 42. — № 1. — С. 77. — ISSN 0582-3250.
- ↑ Dmitry S. Pesnya, Anton V. Romanovsky Comparison of cytotoxic and genotoxic effects of plutonium-239 alpha particles and mobile phone GSM 900 radiation in the Allium cepa test (англ.) (pdf). Mutation Research/Genetic Toxicology and Environmental Mutagenesis (8 октября 2012). Проверено 8 октября 2012.
- ↑ H. Nagasawa, J.B. Littlea, W.C. Inkretb, S Carpenterc, K. Thompsonc, M.R. Rajuc, D.J. Chenc, G.F. Strnistec Cytogenetic effects of extremely low doses of plutonium-238 alpha-particle irradiation in CHO K-1 cells (англ.). Mutation Research Letters (3 июля 1990).
- ↑ 1 2 DOE contributors Plutonium. Nuclear Safety and the Environment. Department of Energy, Office of Health Safety and Security.(недоступная ссылка — история) Проверено 9 октября 2010.
- ↑ Лента.Ру Впервые после холодной войны США возобновляют производство плутония (рус.). Лента.Ру (27.06.2005). Архивировано из первоисточника 23 августа 2011. Проверено 12 октября 2010.
- ↑ Иван Панин. Американцы подтвердили существование 114-го элемента (рус.), Infox.ru (25 сентября 2009).
- ↑ Американские физики подтвердили открытие россиянами 114-го элемента (рус.). Lenta.Ru (25 сентября 2009). Архивировано из первоисточника 23 августа 2011. Проверено 18 ноября 2010.
- ↑ Физики получили шесть новых изотопов сверхтяжелых элементов (рус.). Lenta.ru (27 октября 2010). Архивировано из первоисточника 23 августа 2011. Проверено 8 ноября 2010.
- ↑ Chemical Element 114: One of Heaviest Elements Created (англ.). ScienceDaily Online (26 октября 2010). Архивировано из первоисточника 23 августа 2011. Проверено 25 декабря 2010.
- ↑ 3-я группа периодической системы — редкоземельные элементы, актиний и актиниды // Неорганическая химия. Химия элементов / Третьяков Ю. Д., Мартыненко Л. И., Григорьев А. Н., Цивадзе А. Ю. и др. — Уч. изд. — М.: "Химия", 2001. — Т. 1. — 472 с. — 1000 экз. — ISBN 5-7245-1213-0
- ↑ Barber, R. C.; Greenwood, N. N.; Hrynkiewicz, A. Z.; Jeannin, Y. P.; Lefort, M.; Sakai, M.; Ulehla, I.; Wapstra, A. P.; Wilkinson, D. H. Discovery of The Transfermium Elements (англ.) // IUPAC : статья. — Великобритания, 1993. — В. 65. — № 8. — С. 1757—1814. — DOI:10.1351/pac199365081757
- ↑ DOE contributors. Plutonium: The First 50 Years. — U.S. Department of Energy, 1996.
- ↑ Крючков, Игорь. Наследник назначен, очередь за плутонием (рус.), gzt.ru (26 апреля 2009). Проверено 23 октября 2010.
- ↑ 1 2 The atomic bombing of Nagasaki (англ.). The Manhattan Project (An Interactive History). US Department of Energy. Office of History and Heritage Resources.(недоступная ссылка — история) Проверено 6 ноября 2010.
- ↑ "How many people died as a result of the atomic bombings?" ( (англ.), (яп.)). Frequently Asked Questions. Radiation Effects Research Foundation (2007). Архивировано из первоисточника 23 августа 2011. Проверено 6 ноября 2010.
- ↑ Weapons research crosses the Channel (англ.) // Журнал Nature : статья. — Nature, 4 ноября 2010. — ISSN 0028-0836. — DOI:10.1038/news.2010.583
- ↑ Isaac Asimov. Nuclear Reactors // Understanding Physics. — Barnes & Noble Publishing, 1988. — С. 905. — ISBN 0880292512
- ↑ 1 2 Александр Емельяненков Из плутония выпустят пар (рус.) // "Российская газета" — Государство : статья. — Российская газета, 22 ноября 2007. — В. 4524.
- ↑ Взрыв (рус.). Большая советская энциклопедия. Архивировано из первоисточника 19 декабря 2012. Проверено 18 декабря 2012.
- ↑ Samuel Glasstone, Leslie M. Redman. An Introduction to Nuclear Weapons. — Atomic Energy Commission Division of Military Applications Report WASH-1038, 1972. — С. 12.
- ↑ Крючков, Игорь Этот сближающий атом (рус.). gzt.ru (27 октября 2009).(недоступная ссылка — история) Проверено 23 октября 2010.
- ↑ Пузырев, Денис Южная Корея составила список целей для первоочередного удара на территории КНДР (рус.). gzt.ru (24 сентября 2009).(недоступная ссылка — история) Проверено 23 октября 2010.
- ↑ Сергей Строкань Обогащающие обстоятельства (рус.) // Газета Коммерсантъ : статья. — Коммерсантъ, 2007. — В. 3643. — № 67.
- ↑ Агентство Reuters Пакистан наращивает ядерный потенциал (рус.) // Коммерсантъ Новости : статья. — 2006.
- ↑ GZT.RU. США и РФ подписали план утилизации российского плутония (рус.), gzt.ru (26 сентября 2009). Проверено 23 октября 2010.
- ↑ Россия и США достигли успеха в перезагрузке (рус.), Вести.Ру (25 июня 2010). Проверено 29 октября 2010.
- ↑ США и Казахстан объявили о закрытии ядерного реактора в Актау (рус.). ИТАР-ТАСС (17 ноября 2010).(недоступная ссылка — история) Проверено 17 ноября 2010.
- ↑ США приветствуют закрытие ядерного реактора в Казахстане (рус.). РИА Новости (19 ноября 2010). Архивировано из первоисточника 23 августа 2011. Проверено 4 декабря 2010.
- ↑ 1 2 P. Povinec, J. A. Sanchez-Cabeza. Radionuclides in the environment: International Conference on Isotopes in Environmental Studies : Aquatic Forum 2004, 25-29 October, Monaco. — Elsevier, 2006. — 646 с. — ISBN 0080449093, 9780080449098
- ↑ Marshall Islands Research Could Lead to Resettlement After Nuclear Tests (англ.). ScienceDaily Online (12 февраля 2010). Архивировано из первоисточника 23 августа 2011. Проверено 25 декабря 2010.
- ↑ Pierre Guéguéniat, Pierre Germain, Henri Métivier. Radionuclides in the oceans: inputs and inventories. — L'Editeur : EDP Sciences, 1996. — 231 с. — ISBN 2868832857, 9782868832856
- ↑ Гордон Кaрера 40 лет назад ВВС США потеряли атомную бомбу (рус.). bbcrussian.com (11 ноября 2008). Архивировано из первоисточника 23 августа 2011. Проверено 3 декабря 2010.
- ↑ Тимошенко, Алексей. Роскосмос готовится к полетам на ядерном реакторе (рус.), gzt.ru (28 октября 2009). Проверено 23 октября 2010.
- ↑ Caldicott, Helen. The New Nuclear Danger: George W. Bush’s Military-Industrial Complex. — New York: The New Press, 2002.
- ↑ Thomas P. McLaughlin; Shean P. Monahan; Norman N. Pruvost; Vladimir V. Frolov; Boris G. Ryazanov; Victor I. Sviridov A review of Critically Accidents (англ.) (pdf) 72, 82. Los Alamos National Laboratory (Май 2000). — Обзор аварий, связанных с ядерными материалами.(недоступная ссылка — история) Проверено 23 ноября 2010.
- ↑ Антон Ефремов Зона денежного отчуждения (рус.). УРА-Информ (25 ноября 2010). Архивировано из первоисточника 23 августа 2011. Проверено 28 ноября 2010.
- ↑ 1 2 Chernobyl’s Legacy: Health, Environmental and Socio-Economic Impacts (англ.) (pdf). The Chernobyl Forum: 2003—2005 (second revised version). International Atomic Energy Agency (IAEA). Архивировано из первоисточника 23 августа 2011. Проверено 28 ноября 2010.
- ↑ МАГАТЭ Energy, Electricity and Nuclear Power Estimates for the Period up to 2050 (англ.) // 30-е издание : отчет, pdf. — Австрия, 2010. — С. 14, 18. — ISBN 978-92-0-108010-3. — ISSN 1011-2642.
- ↑ Ed Gerstner Nuclear energy: The hybrid returns (англ.) // Журнал Nature : статья. — 1 июля 2009. — В. 460. — DOI:10.1038/460025a
- ↑ 1 2 Plutonium (англ.). Uses. Los Alamos National Laboratory's Chemistry Division (15 декабря 2003).(недоступная ссылка — история) Проверено 30 декабря 2010.
- ↑ Ping Zhang, Bao-Tian Wang, Xian-Geng Zhao Ground state properties and high pressure behaviour of plutonium dioxide: Systematic density functional calculations (англ.) (pdf). arxiv.org (3 мая 2010). Проверено 16 ноября 2010.
- ↑ 1 2 3 4 Franklin H. Cocks. Energy demand and climate change: issues and resolutions. — Wiley-VCH, 2009. — 251 с. — ISBN 3527324461, 9783527324460
- ↑ Andrew Wilson. Solar system log. — Лондон: Jane's Publishing Company Ltd, 1987. — С. 64. — 128 с. — ISBN 0710604440, 9780710604446
- ↑ Константин Лантратов Плутон стал ближе (рус.) // Газета Коммерсантъ : статья. — Коммерсантъ, 2006. — В. 3341. — № 10.
- ↑ Александр Сергеев Зонд к Плутону: безупречный старт большого путешествия (рус.). — Элементы.Ру, 2006.
- ↑ Тимошенко, Алексей Космическая эра — человек оказался не нужен (рус.). gzt.ru (16 сентября 2010).(недоступная ссылка — история) Проверено 22 октября 2010.
- ↑ Melissa McNamara Space Probe Heads To Pluto - Finally (англ.). CBS News.com (19 января 2006). Архивировано из первоисточника 21 августа 2011. Проверено 7 ноября 2010.
- ↑ Зонд New Horizons "оглянулся" на Юпитер (рус.). РИА Новости (28 июля 2010). Архивировано из первоисточника 23 августа 2011. Проверено 4 декабря 2010.
- ↑ Энергия чистой науки: Ток из коллайдера (рус.) // physics arXiv blog Популярная механика : статья. — 12.08.10.
- ↑ В NASA провели первый тест-драйв нового марсохода (рус.). Lenta.ru (26 июля 2010). Архивировано из первоисточника 3 февраля 2012. Проверено 8 ноября 2010.
- ↑ Станция Mars Odyssey установила рекорд времени работы на орбите (рус.). Деловая газета Взгляд (16 декабря 2010). Архивировано из первоисточника 3 февраля 2012. Проверено 16 декабря 2010.
- ↑ Ajay K. Misra Overview of NASA Program on Development of Radioisotope Power Systems with High Specific Power (англ.) // NASA/JPL : обзор. — San Diego, California, июнь 2006.
- ↑ Traci Watson Troubles parallel ambitions in NASA Mars project (англ.). USA Today/NASA (14 апреля 2008). Архивировано из первоисточника 3 февраля 2012. Проверено 17 декабря 2010.
- ↑ 1 2 Appolo 15. News. Press kit (англ.) (pdf) Стр. 57—58. NASA (National Aeronautics and Space Administration) (15 июля 1971). Архивировано из первоисточника 23 августа 2011. Проверено 10 декабря 2010.
- ↑ 1 2 Devision of Engineering. A Report of the NMAB. — 1-е изд. — National Academies, 1970. — 655 с.
- ↑ Lloyd I. Shure; Harwey J. Schwartz Survey of Electric Power Plants for Space Applications (англ.) (pdf). NASA (декабрь 1965). Проверено 25 декабря 2010.
- ↑ SNAP Power Generators, Except Satellites (англ.). RADNET. Архивировано из первоисточника 3 февраля 2012. Проверено 25 декабря 2010.
- ↑ Planning & Human Systems, Inc. Atomic Power in Space. A History (англ.) (pdf) (март 1987). Архивировано из первоисточника 3 февраля 2012. Проверено 25 декабря 2010.
- ↑ SNAP-21 Programm, Phase II (англ.) // Energy Citations Database : technical report. — США, 1 января 1968. — С. 149 с. — DOI:10.2172/4816023
- ↑ The Pioneer Jupiter Spacecraft (англ.). Electrical Power. NASA History Office (август 2004). Архивировано из первоисточника 23 августа 2011. Проверено 25 декабря 2010.
- ↑ Appolo 17. News. Press kit (англ.) (pdf) Стр. 38—39. NASA (National Aeronautics and Space Administration) (26 ноября 1972). Проверено 25 декабря 2010.
- ↑ ALSEP Off-load (англ.). Appolo 12. Lunar Surface Journal (30 октября 2010). Архивировано из первоисточника 23 августа 2011. Проверено 25 декабря 2010.
- ↑ Space FAQ 10/13 - Controversial Questions (англ.). faqs.org (29 июня 2010). Проверено 25 декабря 2010.
- ↑ Venkateswara Sarma Mallela, V Ilankumaran, N.Srinivasa Rao Trends in Cardiac Pacemaker Batteries (англ.) // Indian Pacing Electrophysiol J : статья. — 1 октября 2004. — В. 4. — № 4.
- ↑ Plutonium Powered Pacemaker (1974) (англ.). Oak Ridge Associated Universities (23 марта 2009). Архивировано из первоисточника 23 августа 2011. Проверено 15 января 2011.
- ↑ Bayles, John J.; Taylor, Douglas SEALAB III – Diver's Isotopic Swimsuit-Heater System (англ.). Department of Defense (1970). Архивировано из первоисточника 23 августа 2011. Проверено 15 января 2011.
- ↑ GZT.RU. В Великобритании взорваны четыре башни АЭС (рус.), gzt.ru (26 сентября 2007). Проверено 23 октября 2010.
- ↑ Кесслер Г. Ядерная энергетика = Nuclear fussion reactors. Potential role and risks of converters and breeders / Пер. с англ. под ред. Митяев Ю. И. — М.: Энергоатомиздат, 1986. — 264 с. — 3700 экз.
- ↑ Марина Чадеева Мирный атом: Ядерная энергетика (рус.). Популярная Механика (апрель 2005). Архивировано из первоисточника 23 августа 2011. Проверено 3 января 2011.
- ↑ Matt McKillop Pu-239 (англ.). Filmcritic.com (1 января 2007). Архивировано из первоисточника 23 августа 2011. Проверено 22 ноября 2010.
Ссылки
 На Викискладе есть медиафайлы по теме Плутоний
На Викискладе есть медиафайлы по теме Плутоний- Плутоний (рус.). Популярная библиотека химических элементов (14 октября 2003 года). Архивировано из первоисточника 23 августа 2011. Проверено 11 октября 2010.
- The Criticality Safety Information Resource Center. A Review of Criticality Accidents: 2000 Revision (англ.). CSIRC. — Обзоры ядерных происшествий, в том числе связанных и с плутонием.(недоступная ссылка — история) Проверено 23 ноября 2010.
- W. G. Sutcliffe, R. H. Condit, W. G. Mansfield, D. S. Myers, D. W. Layton, P. W. Murphy A Perspective on the Dangers of Plutonium (англ.). Lawrence Livermore National Laboratory (14 апреля 1995). Проверено 29 декабря 2010.
- Johnson, C. M.; Davis, Z. S. Nuclear Weapons: Disposal Options for Surplus Weapons-Usable Plutonium (англ.). CRS Report for Congress # 97-564 ENR (22 мая 1997). Проверено 29 декабря 2010.
- Physical, Nuclear, and Chemical, Properties of Plutonium (англ.). IEER (июль 2005). Архивировано из первоисточника 23 августа 2011. Проверено 29 декабря 2010.
- Bhadeshia, H. Plutonium (англ.). University of Cambridge. — Кристаллография плутония. Архивировано из первоисточника 23 августа 2011. Проверено 29 декабря 2010.
- David Samuels End of the Plutonium Age (англ.). Discover Magazine (22 ноября 2005). Архивировано из первоисточника 23 августа 2011. Проверено 29 декабря 2010.
- Pike, J.; Sherman, R. Plutonium Production (англ.). Federation of American Scientists (20 июня 2000). Архивировано из первоисточника 23 августа 2011. Проверено 29 декабря 2010.
- Plutonium Manufacture and Fabrication (англ.). Nuclearweaponarchive.org. Архивировано из первоисточника 23 августа 2011. Проверено 29 декабря 2010.
- Ong, C. World Plutonium Inventories (англ.). nuclearfiles.org (1999). Архивировано из первоисточника 23 августа 2011. Проверено 29 декабря 2010.
- Plutonium, Radioactive (англ.). NLM Hazardous Substances Databank. Архивировано из первоисточника 23 августа 2011. Проверено 29 декабря 2010.
- Annotated Bibliography on plutonium (англ.). Alsos Digital Library for Nuclear Issues. Проверено 29 декабря 2010.
- Chemistry in its element (англ.) (mp3). Plutonium. Royal Society of Chemistry's Chemistry World. Архивировано из первоисточника 23 августа 2011. Проверено 29 декабря 2010.
- И. Я. Василенко, О. И. Василенко Плутоний (рус.) (pdf) — 8 стр. — Воздействие плутония на организм. Архивировано из первоисточника 23 августа 2011. Проверено 30 декабря 2010.
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| Щелочные металлы Щёлочноземельные металлы Лантаноиды Актиноиды Переходные металлы Другие металлы Металлоиды Другие неметаллы Галогены Инертные газы |
 Электрохимический ряд активности металлов Электрохимический ряд активности металлов |
|---|
| Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au Элементы расположены в порядке возрастания стандартного электродного потенциала. |
 Загрязнение Загрязнение |
|
|---|---|
| Загрязнение атмосферы | Кислотный дождь · Индекс качества воздуха · Моделирование атмосферного рассеивания · Галогеноалканы · Глобальное затемнение · Глобальная дистилляция · Глобальное потепление · Качество воздуха · Озоновая дыра · Смог |
| Загрязнение воды | Эвтрофикация · Гипоксия · Экологический мониторинг · Пресноводный экологический показатель качества · Загрязнение океанов · Морской мусор · Окисление океана · Разлив нефти · Фармацевтика и личная гигиена · Корабельное загрязнение · Поверхностный сток · Термальное загрязнение · Городской сток · Сточные воды · Водные заболевания · Качество воды · Застойная вода |
| Загрязнение почв | Биоремедиация · Гербициды · Пестициды |
| Радиационная экология | Актиноиды в природе · Радиоактивность окружающей среды · Продукты деления · Радиоактивное заражение · Плутоний в природе · Лучевая болезнь · Радий в природе · Уран в природе |
| Другие типы загрязнения | Световое загрязнение · Шумовое загрязнение · Радиоактивный спектр загрязнений · Визуальные загрязнения · Электромагнитное загрязнение · Космический мусор |
| Межгосударственные договоры | Монреальский протокол · Киотский протокол · КоТЗВнБР · КЗМССВА · Стокгольмская конвенция |
| Экологические организации | DEFRA · Агентство окружающей среды (Англия и Уэльс) · Scottish Environment Protection Agency (Шотландия) · U.S. EPA · ЕООС · Гринпис |
| В искусстве | Давайте загрязнять (м/ф, 2009, США) |
| См. также | Ксенобиотик · Персистентность |
| Соединения плутония |
|---|
| Гидрид плутония(II) (PuH2) • Гидрид плутония(III) (PuH3) • Карбид плутония (PuC2) • Нитрид плутония (PuN)• Хлорид плутония(III) (PuCl3)• Фторид плутония(III) (PuF3) • Фторид плутония(IV) (PuF4) • Оксид плутония(IV) (PuO2) • Гексафторид плутония (PuF6) • Борид плутония (PuB2) |
| Чрезвычайно опасные вещества |
|---|
 Акролеин • Бензапирен • Бериллий • Винилхлорид • Диметилртуть • Диоксины • Диэтилртуть • Зоман • Линдан • Озон • Оксид свинца • Пентахлордифенил • Полоний • Плутоний • Протактиний • Ртуть (суммарно) • Стрихнин • Таллий • Теллур • Тетраэтилолово • Тетраэтилсвинец • Трихлордифенил • Фтороводород • Хлорокись фосфора • Цианид калия • Цианид натрия • Циановодород • Этилмеркурхлорид Акролеин • Бензапирен • Бериллий • Винилхлорид • Диметилртуть • Диоксины • Диэтилртуть • Зоман • Линдан • Озон • Оксид свинца • Пентахлордифенил • Полоний • Плутоний • Протактиний • Ртуть (суммарно) • Стрихнин • Таллий • Теллур • Тетраэтилолово • Тетраэтилсвинец • Трихлордифенил • Фтороводород • Хлорокись фосфора • Цианид калия • Цианид натрия • Циановодород • Этилмеркурхлорид |
Категории:
- Химические элементы
- Соединения плутония
- Чрезвычайно опасные вещества
- Радиоактивные элементы
- Металлы
- Актиноиды
- Плутоний
Wikimedia Foundation.2010.
Синонимы:
Полезное
Смотреть что такое "Плутоний" в других словарях:
- ПЛУТОНИЙ — (Plutonium), Pu, искусств … Физическая энциклопедия
- ПЛУТОНИЙ — (Plutonium), Pu, искусственный радиоактивный химический элемент III группы периодической системы, атомный номер 94, атомная масса 244,0642; относится к актиноидам; металл, tпл 640 шC. Изотоп 239Pu получают облучением урана 238U нейтронами в… … Современная энциклопедия
- Плутоний — (Plutonium), Pu, искусственный радиоактивный химический элемент III группы периодической системы, атомный номер 94, атомная масса 244,0642; относится к актиноидам; металл, tпл 640 °C. Изотоп 239Pu получают облучением урана 238U нейтронами в… … Иллюстрированный энциклопедический словарь
- ПЛУТОНИЙ — (лат. Plutonium) Pu, химический элемент III группы периодической системы, атомный номер 94, атомная масса 244,0642, относится к актиноидам. Радиоактивен; наиболее устойчивый изотоп 244Pu (период полураспада 8,05.107 лет). Название от планеты… … Большой Энциклопедический словарь
- ПЛУТОНИЙ — (символ Рu), серебристо белый радиоактивный элемент, относится к АКТИНОИДАМ. Был впервые получен в 1940 г. в Калифорнийском университете в Беркли при бомбардировке УРАНА ядрами дейтерия (тяжелого водорода). Встречается в небольших количествах в… … Научно-технический энциклопедический словарь
- ПЛУТОНИЙ — ПЛУТОНИЙ, я, муж. Серебристо белый металл, изотоп к рого является ядерным горючим. | прил. плутониевый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
- плутоний — сущ., кол во синонимов: 6 • актинид (14) • актиноид (16) • металл (86) • … Словарь синонимов
- Плутоний — Рu Plutonium искусственно полученный химический радиоактивный элемент (металл) с атомным номером 94. В природе встречается в ничтожных количествах в урановых рудах. Известны 16 изотопов плутония. Термины атомной энергетики. Концерн Росэнергоатом … Термины атомной энергетики
- плутоний — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en\] EN plutonium A highly toxic metallic transuranic element. It occurs in trace amounts in uranium ores and is produced in a nuclear reactor by neutron bombardment of uranium 238.… … Справочник технического переводчика
- плутоний — я; м. Химический элемент (Pu), радиоактивный серебристо белый металл, относящийся к актиноидам (получается искусственным путём; используется в ядерной энергетике как сырьё для получения ядерного топлива). Оружейный п. (использующийся в атомном… … Энциклопедический словарь